Prin adsorbtie se întelege cresterea concentratiei unei substante la interfata a doua faze (solid - lichid, lichid - lichid, solid - gazos etc.). Aceasta apare sub influenta diferentei de intensitate a fortelor care se exercita între particulele ce formeaza interfata. Natura acestor forte variaza de la forte slabe de natura fizica care provoaca 353n1318d o adsorbtie slaba, adsorbtie fizica, pâna la forte care prin intensitate se apropie de legatura chimica - chimiosorbtie. Adsorbtia este cu atât mai mare cu cât suprafata materialului adsorbant este mai mare (dimensiunile particulelor mai mici). Adsorbtia mai depinde si de încarcarea electrica atât a particulei de adsorbant cât si a moleculelor substantelor adsorbite. Ca medii adsorbante se pot folosi: praful de carbune, diferite soluri fin pulverizate, precum si geluri coloidale, cum este hârtia de filtru.
Procesul de nutritie a celulelor în parte sau a sistemului radicular în întregime începe prin acumularea substantelor nutritive lânga suprafata fiziologic activa si se realizeaza prin doua mecanisme: prin deplasarea activa a organului de absorbtie în substrat si prin procese fizico-chimice de adsorbtie, care determina directia difuziunii.
La tesuturile plantelor se înregistreaza o saturatie cu ioni datorita procesului de adsorbtie, aproximativ dupa o ora de la scufundarea tesuturilor în solutie. S-a observat ca în curs de 10 minute de la introducerea tesuturilor în solutie, ele absorb aproximai 70% din cantitatea de ioni adsorbita pe suprafata sistemului radicular.
Experienta nr. 1
Adsorbtia Pb(NO3)2 pe praful de carbune
Se iau într-o eprubeta 2 ml solutie Pb(NO3)2 0,07% peste care se toarna 1 ml solutie K2Cr2O7 între 2 si 5%. Se obtine un precipitat galben de PbCr2O7. Într-o alta eprubeta se ia solutie de Pb(NO3)2 de aceeasi concentratie si se adauga un vârf de briceag de negru animal. Se agita câteva minute, apoi se filtreaza. În filtratul obtinut se face proba cu K2Cr2O7. Reactia este negativa, deoarece Pb(NO3)2 a fost fixat adsorbtiv pe suprafata particulelor de carbune.
Experienta nr. 2
Adsorbtia violetului de metil de catre sol
 Se foloseste un tub de
sticla îngustat la partea inferioara, care se umple pâna la
jumatate cu sol fin (fig. 1). Deasupra solului se toarna o
solutie diluata (1/10000) de violet de metil. În vasul de culegere se
va scurge un filtrat complet decolorat, deoarece violetul de metil a fost
adsorbit total de catre sol.
Se foloseste un tub de
sticla îngustat la partea inferioara, care se umple pâna la
jumatate cu sol fin (fig. 1). Deasupra solului se toarna o
solutie diluata (1/10000) de violet de metil. În vasul de culegere se
va scurge un filtrat complet decolorat, deoarece violetul de metil a fost
adsorbit total de catre sol.
Experienta nr. 3
Adsorbtia albastrului de metilen si a eozinei de catre gelurile coloidale
Capacitatea diferita de adsorbtie a substantelor se poate demonstra prin adsorbtia albastrului de metilen si a eozinei pe hârtia de filtru, care este un gel coloidal de celuloza, ale carui micele sunt încarcate cu electricitate negativa.
Se iau 3 eprubete perfect uscate. Cu pipeta se introduce în fundul primei eprubete 1 ml de albastru de metilen 0,1%, în a doua eprubeta 1 ml eozina 0,1% si în a treia eprubeta 1 ml de amestec în parti egale de albastru de metilen si eozina în concentratiile mentionate. În fiecare eprubeta se introduce câte o fâsie de hârtie de filtru de 1/20 cm, astfel încât sa intre cu un capat în lichid.
![]() Dupa 2-3 ore se observa urmatorul
aspect: în toate eprubetele apa s-a urcat prin capilaritate pâna la o
anumita înaltime; în prima eprubeta, albastrul de metilen,
fiind un colorant bazic (electropozitiv), se adsoarbe puternic la baza hârtiei
de filtru; în eprubeta a 2-a, eozina, colorant acid (electronegativ), care nu
poate fi adsorbita de micelele coloidale ale hârtiei de filtru, urca
aproape pâna la acelasi nivel cu apa; în eprubeta cu amestec se
observa separarea colorantilor conform proprietatilor lor
adsorbtive (pe fâsia de hârtie de filtru albastrul de metilen ramâne
adsorbit la baza hârtiei, iar eozina urca împreuna cu apa).
Dupa 2-3 ore se observa urmatorul
aspect: în toate eprubetele apa s-a urcat prin capilaritate pâna la o
anumita înaltime; în prima eprubeta, albastrul de metilen,
fiind un colorant bazic (electropozitiv), se adsoarbe puternic la baza hârtiei
de filtru; în eprubeta a 2-a, eozina, colorant acid (electronegativ), care nu
poate fi adsorbita de micelele coloidale ale hârtiei de filtru, urca
aproape pâna la acelasi nivel cu apa; în eprubeta cu amestec se
observa separarea colorantilor conform proprietatilor lor
adsorbtive (pe fâsia de hârtie de filtru albastrul de metilen ramâne
adsorbit la baza hârtiei, iar eozina urca împreuna cu apa).
Experienta nr. 4
Adsorbtia si elutiunea
Fenomenul invers adsorbtiei se numeste elutiune (=substantele fixate adsorbtiv pot fi reluate de pe suprafata materialului adsorbant, folosind solventi convenabili).
Se iau într-o eprubeta 3 ml solutie de fuxina acida 1/10000 peste care se adauga putin negru animal. Se agita eprubeta câteva minute, apoi se filtreaza. Filtratul obtinut va fi incolor. Pe hârtia de filtru vor ramâne particule de carbune pe suprafata carora s-a adsorbit fuxina. Se toarna în pâlnie, peste hârtia de filtru cu carbune, alcool etilic 95%. Acesta elutioneaza fuxina, iar filtratul va fi colorat în rosu.
Experienta nr. 5
Adsorbtia elementelor minerale de catre complexul coloidal al solului
În solurile fertile se gaseste o cantitate apreciabila de coloizi organici si minerali (humati, hidrat feric, silicati, etc.), cu o mare putere de adsorbtie fata de diferiti cationi si anioni din solutia solului.
Se iau doua pâlnii egale (de aproximativ 10 cm) si se pune în ele aceeasi cantitate de pamânt de gradina, pâna la trei sferturi din înaltimea lor, dupa ce în prealabil s-a pus la baza lor putina vata, ca sa împiedice caderea particulelor de pamânt în jos.
Peste pamântul din prima pâlnie se toarna încet o solutie de fosfat acid de potasiu sau de sodiu 0,125 %, astfel ca sa nu se scurga din ea nimic în vasul colector. Dupa 1-2 ore se adauga peste pamântul din pâlnie apa distilata, care se colecteaza în vasul de sub pâlnie. Se iau din aceasta solutie 1-2 ml într-o eprubeta si se toarna peste ea solutie de molibdat de amoniu 10%. Prin încalzire se obtine un precipitat galben caracteristic de fosfomolibdat de amoniu, care comparat cu fosfomolibdatul de amoniu obtinut din solutia initiala (înainte de trecerea prin sol), se prezinta mult mai slab, deoarece coloizii solului au adsorbit o parte din anionii fosfatului cu care s-a lucrat. Când solul este mai bogat în coloizi, ionii pot fi retinuti complet.
Peste solul din pâlnia a doua se toarna încet, pentru a avea timp sa se adsoarba, o solutie de KNO3 1%. Cu lichidul colectat în vasul de sub pâlnie se face proba cu difenilamina. Se va obtine o coloratie albastra, care în comparatie cu cea obtinuta într-o portiune din solutia initiala va fi mult mai deschisa.
1.1.2. Imbibitia
Imbibitia este capacitatea coloizilor macromoleculari de a absorbi lichid, marindu-si volumul. Prin imbibitie apa patrunde în diferite substante, dar si în organele plantelor. În imbibitie, viteza de difuziune a moleculelor de lichid fiind mai mare, ele patrund si se repartizeaza printre macromoleculele substantei care se îmbiba. Patrunderea lichidului determina îndepartarea macromoleculelor între ele, iar volumul coloidului creste. Se cunosc doua tipuri de imbibitie: imbibitie nelimitata, când coloidul macromolecular trece total în solutie, si imbibitie limitata, când corpul îmbibat ramâne în stare de gel, pastrându-si forma initiala. Fenomenul de imbibitie este reversibil. Ca urmare, un corp scos din apa, prin pierderea ei, revine dupa un anumit timp la greutatea si volumul initiale.
Imbibitia substantelor în apa difera mult, fiind influentata de mai multi factori: natura substantelor, temperatura, valoarea pH-ului.
În imbibitie se observa urmatoarele fenomene caracteristice:
cresterea volumului coloidului
contractia volumului total: W<V+V', unde W=volumul coloidului îmbibat; V=volumul lichidului uscat; V'=volumul lichidului care îmbiba.
eliberare de energie mecanica
eliberare de energie calorica
Particulele coloidale bogate în grupari hidrofile atrag si retin apa care se fixeaza în straturi orientate la suprafata particulelor (prin adsorbtie) si în interiorul lor (prin imbibitie). Când acesti coloizi sunt subîmbibati, micelelor lor sunt apropiate unele de altele si înconjurate de un strat subtire de molecule de apa. Când absorb apa, micelele se îndeparteaza între ele, se lungesc si stratul de apa ce le înconjoara creste considerabil.
La o celula matura, aflata în stare de viata activa, este dificil de evidentiat partea ce revine fortelor de imbibitie în schimburile de apa ale ei, deoarece aceste forte sunt însotite, în special, de forte osmotice. Pentru a analiza influenta fortelor de imbibitie în acest schimb, trebuie folosit un material vegetal la care aceste forte sunt dominante: meristemele apicale ale tulpinilor si radacinilor, semintele si sporii. Coloizii hidrofili din membranele scheletice pectocelulozice, din citoplasma si incluziunile sale vii, precum si din vacuolele punctiforme atrag apa. Fenomenul este evident în meristemele apicale ale radacinilor s tulpinilor, ale caror celule au o citoplasma foarte densa si bogata în coloizi putin hidratata, iar vacuolele sunt punctiforme. Imbibitia intervine de asemenea la semintele si sporii care, în urma deshidratarii, se gasesc în stare de viata latenta. Citoplasma celulelor la seminte este densa, iar vacuolele sunt reduse la granule de aleurona. Patrunderea apei prin imbibitie într-o celula depinde de diferenta dintre forta de imbibitie I si presiunea contrara a membranei scheletice Pm. Patrunderea apei prin imbibitie se face pâna când diferenta I-Pm devine nula.
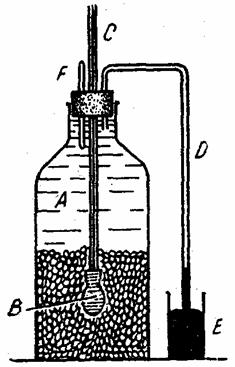
Experienta nr. 6
Experienta Coupin de punere în evidenta a caracteristicilor imbibitiei
Se monteaza un dispozitiv ca în fig. 2. În vasul A se pun seminte (de lupin, mazare, fasole etc.) cu testa perforata. Prin una din deschiderile dopului trece tubul de sticla C, care este în legatura cu para de cauciuc B plina cu mercur. Prin alta deschidere a aceluiasi dop trece tubul de sticla D îndoit de doua ori în unghi drept si care este introdus cu un capat în vasul E, de asemenea plin cu mercur. A treia deschidere a dopului serveste la scoaterea aerului care ar ramâne sub dop în timpul închiderii flaconului. Se umple vasul cu apa. Se astupa cu dopul, iar aerul iese prin a treia deschidere. Dupa evacuarea aerului, deschiderea se astupa cu bagheta de sticla F. Bagheta se introduce în flacon astfel încât apa dezlocuita de ea, plecând prin tubul D, sa ajunga la suprafata mercurului din vasul E. Dupa un timp se constata ca semintele se îmbiba exercitând între ele o presiune care se va manifesta si asupra parei B, facând ca mercurul sa urce în tubul C. În acelasi timp mercurul începe sa urce si în tubul D, ceea ce pune în evidenta contractia volumului total.
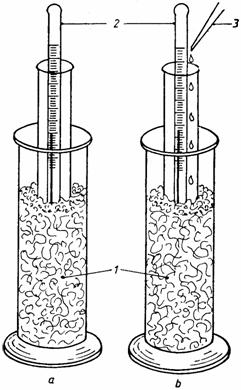
Experienta nr. 7
Producerea de energie calorica în fenomenul de imbibitie
Se iau 2-3 g de amidon uscat si se pun în doua eprubete perfect uscate. În fiecare eprubeta se introduce câte un termometru si se pun fiecare în vase termoizolatoare (fig. 3).
![]() În una din eprubete
se toarna 5-6 picaturi de apa, cealalta eprubeta
servind de control. Se va constata ca în eprubeta unde a avut loc
imbibitia amidonului cu apa, temperatura a urcat cu 2-3oC
fata de eprubeta de control. Aceasta eliberare de
caldura este consecinta contractarii apei de imbibitie
atunci când energia cinetica a moleculelor de apa care formeaza stratul
orientat este eliberata sub forma de energie calorica.
În una din eprubete
se toarna 5-6 picaturi de apa, cealalta eprubeta
servind de control. Se va constata ca în eprubeta unde a avut loc
imbibitia amidonului cu apa, temperatura a urcat cu 2-3oC
fata de eprubeta de control. Aceasta eliberare de
caldura este consecinta contractarii apei de imbibitie
atunci când energia cinetica a moleculelor de apa care formeaza stratul
orientat este eliberata sub forma de energie calorica.
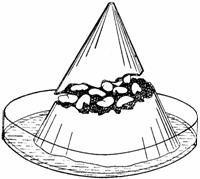
Experinta nr. 8
Producerea de energie mecanica în fenomenul de imbibitie
Pentru evidentierea acestei energii, se toarna într-o pâlnie tapisata cu hârtie umeda si asezata într-un inel fixat la un stativ, pâna la jumatate cu o pasta de gips. Se aseaza deasupra un strat de seminte de fasole uscate si se umple apoi pâlnia cu gips. Dupa solidificarea gipsului se
 scoate conul format
si se introduce cu baza într-un vas care contine un strat de apa
(fig. 4).
scoate conul format
si se introduce cu baza într-un vas care contine un strat de apa
(fig. 4).
Dupa câteva ore conul de gips este sfarâmat, ca urmare a energiei mecanice rezultata din imbibitia semintelor. Energia mecanica apare ca rezultat al îndepartarii micelelor gelului uscat, prin patrunderea moleculelor de apa între micele. Eliberarea de energie mecanica este deosebit de puternica la imbibitia gelurilor coloidale elastice, cum sunt gelurile proteice din substanta de rezerva a semintelor de fasole. Aceasta energie determina ruperea tegumentelor seminale în timpul germinatiei.

![]()
Experienta nr. 9
Influenta electrolitilor asupra imbibitiei proteinelor
Se taie placi de gelatina de 20 mm lungime si 10 mm latime, care se pun în numar de trei în cutii Petri la îmbibat, în urmatoarele variante: în apa, în solutie de KCl, NaCl si LiCl 2M (fig. 5). Rezultatele se pot lua dupa 3 sau 24 de ore. Se masoara foitele de gelatina cu o rigla direct în solutie, fara sa fie scoase afara. O conditie pentru reusita experientei este executarea ei la o temperatura mai mica de 22oC, când imbibitia gelatinei este limitata, adica foita pusa la îmbibat îsi pastreaza forma.
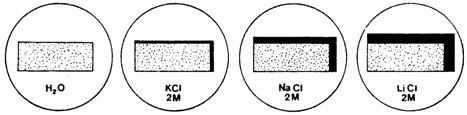
Fig. 5. Influenta electrolitilor asupra imbibitiei proteinelor
Se va constata ca lungimea acestor placi va fi maxima în solutie de LiCl si va descreste în celelalte variante astfel: NaCl>KCl>H2O.
Explicarea mecanismului imbibitiei în electroliti se bazeaza pe consideratia ca ionii care se fixeaza pe micela coloidala aduc si apa lor de hidratare (dipolii de apa) si astfel imbibitia este mai redusa.
Experienta nr. 10
Influenta electrolitilor asupra imbibitiei substantelor mucilaginoase din testa semintelor de in
Se introduc în patru eprubete aceleasi cantitati de seminte de in (care au testa bogata în mucilagii) si se marcheaza nivelul lor initial. Se adauga apoi în eprubete, în aceleasi cantitati, în prima apa, în a doua solutie de KCl 2M, în a treia NaCl 2M, iar în a patra LiCl 2M (fig. 6). Se va costata ca semintele se vor îmbiba în mod diferit. Dupa 24 de ore se masoara diferentele de nivel la care au ajuns semintele îmbibate si se noteaza rezultatele obtinute. În apa, imbibitia este mai mare decât în electroliti, care formeaza seria: KCl>NaCl>LiCl.
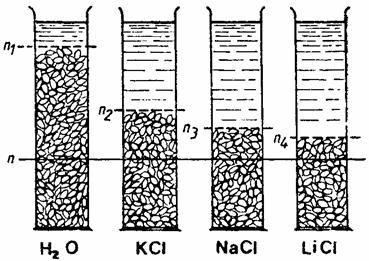
Fig. 6. Influenta electrolitilor asupra imbibitiei substantelor
mucilaginoase din testa semintelor de in
Spre deosebire de substantele proteice, substantele hidrocarbonate se îmbiba mai mult cu apa decât cu solutii de electroliti. Aici, ionii dizolvati în apa au retinut apa cu putere. Efectul ionilor fixati pe micela este mai mic decât efectul celor ramasi în solutie, care retin apa.
1.1.3. Difuziunea
Difuziunea este fenomenul prin care doua sau mai multe tipuri de particule (ioni sau molecule) se amesteca în cazul în care vin în contact, datorita miscarilor lor cinetice. Sensul miscarii este întotdeauna de la substanta mai concentrata catre cea mai diluata, chiar împotriva gravitatiei.
În cazul radacinii, absorbtia activa a substantelor prin plasmalema, în celule, determina diluarea solutiei din apoplast si, ca urmare, difuzia substantelor din solutia solului spre acesta. Transportul pasiv al ionilor prin membranele plasmatice are loc fara consum de energie si se realizeaza prin difuziune simpla sau difuziune facilitata, care se produce prin canalele proteice.
O definitie mai precisa este urmatoarea: difuziunea este miscarea unei substante dintr-o zona cu un înalt potential chimic spre o zona cu un scazut potential chimic, care este determinata de energia cinetica a moleculelor, ionilor si atomilor.
Directia de difuziune a unei substante este determinata doar de diferenta de potential chimic a acelei substante si este independenta de difuziunea altor substante.
Viteza de difuziune a substantelor depinde de masa particulelor care difuzeaza, de concentratie, vâscozitatea, temperatura mediului încunjurator, precum si de alti factori.
Dupa legea lui Fick, cantitatea de substanta difuzata (dm) exprimata în grame, în timpul dt se exprima prin formula:
dm=D.A. (dc/dx)xdt,
în care A este aria sectiunii transversale prin care se face difuziunea, D este coeficientul de difuziune, iar dc/dx este gradientul de concentratie (scaderea concentratiei pe unitatea distantei). Legea lui Fick este valabila si în cazul particulelor dizolvate si al solventului.
Daca exista în solutie un gradient de potential electric, sarcinile pozitive si negative se misca în directii opuse (electrodifuziune).
În sistemele biologice, unde difuziunea substantelor are loc prin membrane cu permeabilitate redusa (membrane lipidice), legea lui Fick este valabila cu aproximatie. În acest caz, particulele care difuzeaza au nevoie de energie cinetica pentru a învinge barierele de potential electric în trecerea lor de la o fata a membranei la cealalta fata. O anumita particula poate sa se miste de la o pozitie la alta daca ea câstiga suficienta energie de activare din ciocnirile sale cu particulele vecine. În acest caz, difuziunea are un coeficient mai ridicat la temperatura si astfel mai multe particule pot sa-si procure energia necesara pentru difuziune.
Experienta nr. 11
Influenta masei moleculare asupra vitezei de difuziune
La cele doua capete ale unui tub de sticla se introduce câte un tampon de bumbac. Daca se îmbiba simultan cele doua tampoane, unul cu hidroxid de amoniu si celalalt cu acid clorhidric, în interiorul tubului se vor gasi doua gaze care difuzeaza: NH3 si HCl. Locul unde cele doua gaze se întâlnesc este indicat de inelul alb de clorura de amoniu. Se observa ca inelul este mai aproape de capatul îmbibat cu HCl (deoarece gazul cu masa moleculara mai mica - NH3 - a avut o viteza de difuziune mai mare).
Experienta nr. 12
Difuziunea cristaloidelor în apa
Într-o eprubeta se introduce cu o pipeta o solutie de CuSO4 20%. Deasupra se toarna cu o pipeta un strat de apa, având grija ca cele doua lichide sa nu se amestece initial. Se marcheaza cu un creion gras limita de separare între cele doua lichide, apoi se lasa eprubeta în repaus. Dupa un timp (3-48 ore) se observa difuziunea CuSO4 prin colorarea treptata a stratului de apa.
Experienta nr. 13
Difuziunea cristaloidelor în geluri coloidale
Se dizolva într-un flacon plasat într-o baie de apa fierbinte, 10 g de gelatina în 100 ml de apa distilata si, dupa ce s-a racit putin, se amesteca cu 10 ml de solutie de AgNO3 0,1n. Solul obtinut se toarna apoi, pâna la aceeasi înaltime, în 5 eprubete izodiametrice. Dupa gelificare se marcheaza meniscul lor si se adauga apoi în eprubete câte 3 ml din urmatoarele solutii: în prima eprubeta KCl, în a doua NaCl, în a treia CaCl2, în a patra MgCl2, în a cincea AlCl3, toate în concentratie de 1n. Se eticheteaza eprubetele si se aseaza în stativ, la întuneric, pentru a împiedica reducerea argintului la argint metalic. Difuziunea ionilor este însotita de formarea clorurii de argint, de culoare alba, astfel ca frontul de înaintare a curentului de difuzie se delimiteaza perfect. Dupa 24 de ore se observa rezultatele masurând lungimea coloanei de precipitat (fig. 7).
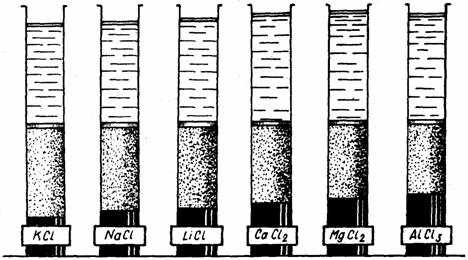
Fig. 7. Difuziunea cristaloidelor în geluri coloidale
Viteza de miscare a electrolitului este determinata de marimea învelisului de apa pe care ionii sai au legat-o prin forte electrostatice. Marimea acestei capacitati de hidratare depinde de valenta cationului; la valente egale depinde de raza ionului, adica de numarul de straturi de electroni care înconjoara nucleul. Cu cât raza este mai mare, cu atât cantitatea de apa extrasa de ioni este mai mica. Astfel, dupa viteza de difuziune a cationilor se poate întocmi seria: K+>Na+>Li+>Ca++>Mg++>Al+++.
Experienta nr. 14
Difuziunea coloidelor în geluri coloidale
Viteza de difuziune a coloidelor în geluri coloidale este invers proportionala cu masa lor moleculara.
Se prepara un sol de gelatina 10%, care se toarna, pâna la acelasi nivel, în 7 eprubete izodiametrice. Dupa gelificare se adauga în fiecare eprubeta câte 2 ml din urmatoarele solutii coloidale: în prima eprubeta rosu neutru (M = 225,279) 1/10000, în a doua albastru de metilen (M = 284,410) 1/10000, în a treia albastru de anilina (M = 516,671), în a patra eozina (M =647,948) 1/10000, în a cincea tus negru, în a sasea rosu de Congo (M = 667,666) 1/10000 si în a saptea clei de amidon 0,1% (M ~ 1000000). Dupa 24 - 48 de ore se observa ca primele 4 substante patrund la niveluri diferite în gelul coloidal, formând o scara descrescatoare, iar celelalte 3 substante nu difuzeaza deloc (fig 8).

Fig. 8. Difuziunea coloidelor în geluri coloidale
1.1.4. Osmoza
Osmoza este un caz special de difuziune, adica de întrepatrundere a doua solutii de concentratii diferite separate printr-o membrana. În fenomenul de osmoza deplasarea solutiilor se face în sens opus difuziunii, adica are loc trecerea dizolvantului prin membrana catre mediul mai concentrat, ducând astfel la uniformizarea concentratiilor.
Membranele separatoare pot fi permeabile si semipermeabile.
Prin membranele permeabile naturale si artificiale, trec apa si sarurile minerale dizolvate si foarte greu sau deloc substantele coloidale cu micele mai mari.
Membranele semipermeabile pot fi naturale si artificiale. Semipermeabilitatea membranei artificiale de ferocianura de cupru este absoluta deoarece permite numai trecerea apei, spre deosebire de membranele plasmatice de la celulele vii, care au o semipermeabilitate relativa, adica permit trecerea apei, a ionilor minerali si a altor substante.
Osmoza este un proces pasiv, generat de potentialul osmotic, dar realizarea si mentinerea acestui potential necesita consum de energie. Din aceasta cauza, blocarea procesului de respiratie si lipsa energiei biochimice împiedica absorbtia apei în celule.
În cazul osmozei, sensul si viteza de trecere a apei prin membrane sunt determinate nu numai de gradientul de concentratie sau de gradientul de presiune, ci de suma celor doua forte. Aceasta observatie a condus la dezvoltarea conceptului de forta totala conducatoare, denumita în fiziologie gradientul potentialului apei sau potentialul apei. Rezulta deci ca potentialul apei din plante reprezinta suma potentialului de turgescenta, a potentialului osmotic si a potentialului matricei celulare.
Sensul de transport al apei este determinat de diferentele de concentratie dintre solutia intracelulara si solutia solului. În cazul în care solutia solului si solutia intracelulara au aceeasi concentratie, adica sunt izotonice, nu are loc transport de apa prin membranele plasmatice.
În cazul în care solutia solului este mai diluata, adica este hipotonica fata de solutia intracelulara (sucul vacuolar), apa patrunde în celula prin endosmoza, trecând prin bistratul de fosfolipide al plasmalemei. Ajunsa în citoplasma, apa trece prin tonoplast si intra în vacuola unde se gaseste cea mai mare cantitate de substante osmotic active. Acest fapt determina cresterea volumului vacuolei, care exercita o presiune asupra citoplasmei, iar aceasta preseaza, la rândul ei, asupra peretelui celular. Celula saturata cu apa se afla în stare de turgescenta. presiunea hidrostatica care ia nastere dupa saturarea celulei cu apa este cunoscuta sub denumirea de presiune de turgescenta, iar starea de saturare a celulelor cu apa reprezinta starea normala de turgescenta.
Osmoza prin membrane permeabile
Experienta nr. 15
Osmometrul Dutrôchet
Acest osmometru poarta numele botanistului francez R.H.Joachim Dutrôchet (1776 - 1847), întemeietorul osmometriei.
![]() Osmometrul Dutrôchet este alcatuit
dintr-un tub de sticla alungit si largit la un capat (fig.
9). La capatul lui largit, cu ajutorul unui fir de ata, se
fixeaza o membrana degresata si umectata de tub de
intestin de porc. Cu ajutorul unei pipete se introduce în el prin capatul
opus, o cantitate de solutie de NaCl 10% pâna la un anumit nivel,
care se marcheaza cu un creion gras. Partea inferioara, la care a
fost legata membrana, se scufunda într-un cristalizor cu apa
distilata si apoi osmometrul se fixeaza la un stativ. Se
constata, destul de repede, ca nivelul solutiei din intestin se
ridica treptat pâna la un nivel maxim. Dupa câteva ore nivelul
începe sa scada pâna când lichidele din osmometru si din
cristalizor ajung la aceeasi înaltime. În acest moment se
stabileste izotonia între cele doua solutii.
Osmometrul Dutrôchet este alcatuit
dintr-un tub de sticla alungit si largit la un capat (fig.
9). La capatul lui largit, cu ajutorul unui fir de ata, se
fixeaza o membrana degresata si umectata de tub de
intestin de porc. Cu ajutorul unei pipete se introduce în el prin capatul
opus, o cantitate de solutie de NaCl 10% pâna la un anumit nivel,
care se marcheaza cu un creion gras. Partea inferioara, la care a
fost legata membrana, se scufunda într-un cristalizor cu apa
distilata si apoi osmometrul se fixeaza la un stativ. Se
constata, destul de repede, ca nivelul solutiei din intestin se
ridica treptat pâna la un nivel maxim. Dupa câteva ore nivelul
începe sa scada pâna când lichidele din osmometru si din
cristalizor ajung la aceeasi înaltime. În acest moment se
stabileste izotonia între cele doua solutii.
La început solutia din osmometru era hipertonica în raport cu apa din cristalizor si, ca urmare, apa patrunde prin osmoza în osmometru datorita curentului endosmotic. Concomitent si substanta dizolvata traverseaza membrana printr-un curent exosmotic. Astfel, solutia din osmometru se dilueaza treptat, iar cea din cristalizor se concentreaza. Predominarea initiala a curentului endosmotic se explica prin faptul ca la început moleculele de apa din cristalizor sunt în numar mai mare, la unitatea de volum, decât cele din osmometru, în care se gasesc si ioni de Na+ si Cl-. Ca urmare, energia cinetica a moleculelor de apa din cristalizor este mai mare, si, loviturile lor pe membrana fiind mai dese, ele strabat mai repede membrana.
Experienta nr. 16
Hipotonie, izotonie si hipertonie
Se iau 3 cristalizoare: în primul se introduce apa, în al doilea si al treilea NaCl 20% (fig. 10). De asemenea, se iau 3 tuburi de intestin de porc lungi de câte 10 cm. Se leaga cu o sfoara la câte un capat. Dupa aceasta operatie, se introduce într-unul din tuburi o solutie de NaCl 20% si se leaga apoi la celalalt capat. Se clateste apoi tubul cu apa si se introduce în primul cristalizor. În al doilea cristalizor se introduce al doilea tub de intestin plin cu NaCl 20%, iar în al treilea cristalizor se introduce al treilea tub de intestin plin cu apa. Se lasa în repaus 1 - 2 ore, dupa care se iau rezultatele.
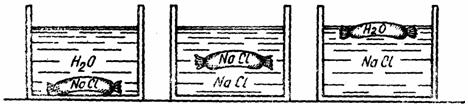
Fig. 10. Hipotonie, izotonie si hipertonie
La cristalizorul 1, apa din exterior va fi atrasa printr-un curent endosmotic de NaCl 20% din interiorul "celulei" (aceasta se va umfla si va ajunge în stare de turgescenta). Apa se considera a fi o solutie hipotonica fata de solutia din interiorul tubului, care este hipertonica fata de apa.
În cristalizorul 2, "celula" va ramâne în starea initiala, cele doua solutii fiind izotonice (de aceeasi concentratie).
În cristalizorul 3, apa din interiorul tubului de intestin va iesi afara, "celula" se zbârceste, ajunge în stare de plasmoliza.
Osmoza prin membrane semipermeabile
Experienta nr. 17
Celula artificiala a lui Traube
a) Se pune într-o eprubeta o solutie de CuSO4 0,5n. Cu ajutorul unei pipete se introduce, prelingând pe perete, o picatura de solutie de ferocianura de potasiu 1n. Picatura de ferocianura de potasiu se va înconjura imediat de o membrana semipermeabila de precipitare, fragila, de ferocianura de cupru:
K4[ Fe (CN)6] + 2CuSO4 = Cu2[ Fe (CN)6] + 2K2SO4
Prin formarea membranei, solutie de ferocianura de potasiu se va delimita de solutia de CuSO4, sub forma unei "celule". Concentratia celor doua solutii va fi diferita, între ele se va stabili un intens curent osmotic. Apa din solutia de CuSO4, care este mai putin concentrata, va trece osmotic prin membrana semipermeabila spre solutia mai concentrata de ferocianura de potasiu din interiorul "celulei". Membrana "celulei" se va umfla, va crapa, iar cele doua solutii, intrând în contact direct, vor reface membrana. Procesul va continua pâna la uniformizarea concentratiilor (fig. 11).

 b)
Într-o eprubeta cu solutie de ferocianura de potasiu se da
drumul unui cristal de CuSO4. Cristalul se înconjoara imediat
cu precipitatul de ferocianura cuprica, cu aspect de membrana,
care creste cu timpul sub forma unui deget de manusa.
Mecanismul de crestere a precipitatului este acelasi, intrarea
endosmotica a apei din solutia de ferocianura de potasiu fiind
cauzata de hipertonia solutiei interne de CuSO4.
b)
Într-o eprubeta cu solutie de ferocianura de potasiu se da
drumul unui cristal de CuSO4. Cristalul se înconjoara imediat
cu precipitatul de ferocianura cuprica, cu aspect de membrana,
care creste cu timpul sub forma unui deget de manusa.
Mecanismul de crestere a precipitatului este acelasi, intrarea
endosmotica a apei din solutia de ferocianura de potasiu fiind
cauzata de hipertonia solutiei interne de CuSO4.
Acelasi rezultat se obtine si în cazul când se inverseaza ordinea substantelor, adica prin adaugarea unui cristal de ferocianura de potasiu într-o solutie de CuSO4 3%.
Experienta nr. 18
Pregatirea de membrane semipermeabile rezistente
Se ia un osmometru scurt, se leaga la partea inferioara cu o hârtie de celofan care s-a înmuiat în apa calduta. Se pregateste o solutie de gelatina 10%. În osmometrul legat cu celofan, care se mentine cald deasupra unei bai, se toarna solutia de gelatina fierbinte, atât cât sa formeze un strat uniform, gros de 2 - 3 mm, pe toata suprafata celofanului (fig. 12). Osmometrul fixat în stativ se lasa în repaus pentru a se raci. Când gelatina s-a întarit, se toarna în osmometru circa 5ml de CuSO4 3% si apoi se introduce cu membrana într-o solutie de ferocianura de potasiu 3%. Osmometrul fixat în stativ se lasa sa stea în solutie timp de 24 de ore. Solutiile de CuSO4 si ferocianura de potasiu vor difuza în gelatina. La locul de întâlnire se va forma un precipitat de ferocianura de cupru, de culoare bruna, care se depune uniform, formând o membrana semipermeabila rezistenta, deoarece a luat nastere pe un schelet de gelatina. Dupa 24 de ore se spala osmometrul la exterior si interior cu apa distilata apoi se poate monta cu o solutie osmotic activa.
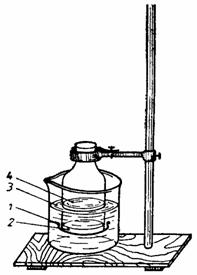
Experienta nr. 19
Substante osmotic active si osmotic inactive
 Sucul
vacuolar este o solutie apoasa în care sunt dizolvate particule (ioni
si molecule) de substante minerale si de substante organice
(zaharuri simple, acizi organici, taninuri, glucozizi, acizi aminici etc.),
care, având dimensiuni mici, maresc concentratia solutiei
si ca urmare "atrag" apa. Ele sunt substante osmotic active.
Substantele organice cu molecula mare, cum sunt proteinele si
amidonul, contribuie putin la concentratia solutiei si nu
"atrag" apa. Ele sunt substante osmotic inactive.
Sucul
vacuolar este o solutie apoasa în care sunt dizolvate particule (ioni
si molecule) de substante minerale si de substante organice
(zaharuri simple, acizi organici, taninuri, glucozizi, acizi aminici etc.),
care, având dimensiuni mici, maresc concentratia solutiei
si ca urmare "atrag" apa. Ele sunt substante osmotic active.
Substantele organice cu molecula mare, cum sunt proteinele si
amidonul, contribuie putin la concentratia solutiei si nu
"atrag" apa. Ele sunt substante osmotic inactive.
Se iau 2 morcovi sau 2 cartofi egali si se scobesc câtiva cm. În scobitura unuia din morcovi se introduce NaCl cristalizat, iar în scobitura celuilalt amidon. Dupa 1-2 zile se va observa ca morcovul în care s-a pus NaCl s-a zbârcit, în timp ce celalalt ramâne în starea initiala de turgescenta. Clorura de sodiu, fiind o substanta osmotic activa, atrage apa din tesuturi, plasmolizându-le. Amidonul este o substanta osmotic inactiva si nu va provoca plasmoliza tesuturilor.
Experienta nr. 20
Echilibrul Donnan
Solutiile cristaloide ajung, prin dializa, la un echilibru osmotic de o parte si de alta a membranei (Dializa este fenomenul de trecere a unei substante dizolvate printr-o membrana permeabila, care desparte solutia de dizolvantul pur.). Coloidele însa, desi dezvolta presiuni osmotice foarte mici, pot influenta starea de echilibru osmotic, provocând hipertonia mediului intern prin stabilirea echilibrului Donnan, denumit astfel dupa numele descoperitorului sau, F. Donnan.
Pentru evidentiere se leaga o membrana dializanta la capatul unui tub de sticla mic si se introduce în el o solutie de rosu de Congo 0,1 M, adica sarea de sodiu a unui anion coloidal nedializabil. Se astupa tubul cu un dop, care este strabatut de un tub capilar, astfel încât colorantul sa se urce în capilar putin deasupra dopului pâna la nivelul 0 (fig. 13), dupa care se introduce cu membrana într-o solutie de NaCl 0,1 M, aflata într-un cristalizor.
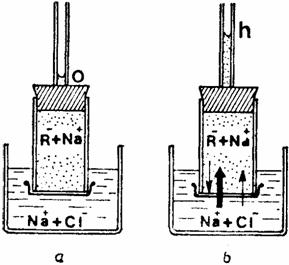
Fig. 13. Echilibrul Donnan
Întrucât ionii de Na+ si Cl- pot dializa, solutia din tub devine hipertonica fata de cea externa, prin acumularea din exterior în special a cationilor, stabilindu-se un echilibru electrostatic de o parte si de alta a membranei: este echilibrul Donnan sau echilibrul de membrana. Fenomenul se explica astfel: datorita masei moleculare diferite a celor doua substante (rosul de Congo are masa moleculara de 696,67 si contine numai doi atomi de Na care pot disocia în ioni Na+, iar NaCl are masa moleculara de 58,44), initial sunt mai multi ioni de Na+ în solutia externa si ei dializeaza, dupa legea difuziei, patrunzând în tub; în procesul difuziei ionii de semn contrar nu se despart, astfel ca, odata cu ionii de sodiu dializeaza si cei de clor, care, fiind însa respinsi de ionul coloidal nedializabil R- al substantei din tub, ajung în solutia interna în cantitate mult mai mica. Stabilirea echilibrului Donnan se constata prin urcarea solutiei interne la nivelul h.
1.2.
Celula vegetala ca sistem osmotic
Celula vegetala contine sucul vacuolar - solutie apoasa în care sunt dizolvate diferite substante minerale si substante organice cu molecula mica (zaharoza, acizi organici etc.) care manifesta o anumita tonicitate, iar prezenta acestor substante osmotic active face posibila atragerea apei. Celula vegetala poseda membrane semipermeabile selective (plasmalema si tonoplastul) care separa medii de concentratii diferite.
Experienta nr. 21
Turgescenta, plasmoliza si deplasmoliza
În cazul în care o celula vegetala vie se afla într-un mediu hipotonic, apa din mediu patrunde în ea printr-un curent endosmotic si celula îsi mareste volumul. Elasticitatea membranei este însa redusa, fapt ce face ca ea sa exercite o contrapresiune din ce în ce mai mare asupra continutului celular. Aceasta este presiunea membranei, care imprima o stare de rigiditate, de tensiune, care se numeste turgescenta. Aceasta este starea normala a celulelor vegetale bine aprovizionate cu apa, care ofera o mare rigiditate tesuturilor, permitând portul erect al plantelor ierboase si portul caracteristic al frunzelor si ramurilor tinere de la plantele lemnoase. Modificarile de turgescenta explica efectuarea unor miscari la plante.
În cazul în care celulele vegetale sunt plasate într-un mediu hipertonic, apa iese din ele printr-un curent exosmotic, turgescenta lor dispare, apoi plasmalema începe sa se desprinda de peretii celulari, mai întâi la colturile celulei (plasmoliza incipienta), apoi si în alte zone (plasmoliza concava) si apoi aproape total (plasmoliza finala sau convexa). În stadiul de plasmoliza convexa protoplasma este contractata în jurul vacuolei, ramânând în contact cu peretii celulari prin niste filamente fine (firele lui Hecht). Vacuola este puternic deshidratata si adesea se fragmenteaza în vacuole mici (fig. 14).
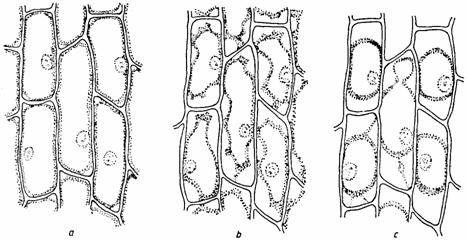
Fig. 14. Plasmoliza: a - incipienta; b - concava; c - convexa.
Se taie o portiune mica din epiderma inferioara a unei frunze modificate dintr-un bulb de Allium cepa, se întinde bine pe o lama de sticla într-o picatura de KNO3 1M, se acopera cu lamela si se examineaza la microscop. Se va constata ca plasmoliza totala se instaleaza dupa aproximativ 20 de minute, trecând prin fazele descrise. Observatia este mult usurata în cazul când celulele sunt colorate în prealabil cu rosu neutru, sau în cazul în care se folosesc epiderme de la plante care contin antociani în vacuole (ceapa rosie, petale de Anemone etc.).
Pentru evidentierea deplasmolizei celulare se procedeaza astfel: dupa observarea stadiului final de plasmoliza, daca se înlocuieste cu precautie solutia de KNO3 cu apa de conducta (punând o picatura de apa pe marginea lamelei si absorbind de cealalta parte cu hârtia de filtru), vacuola, având un suc celular concentrat, va suge apa, ceea ce cu timpul duce la refacerea turgescentei celulelor.
Experienta nr. 22
Determinarea presiunii osmotice prin procedeul plasmolizei incipiente (metoda Hugo de Vries)
Cunoasterea valorii presiunii osmotice are nu numai o importanta teoretica, ci si o importanta practica întrucât ofera indicii asupra gradului de aprovizionare cu apa a plantelor, a carui cunoastere este deosebit de importanta în cazul plantelor agricole cultivate în conditii de irigare. Ideal ar fi ca determinarea presiunii osmotice a sucului celular sa se efectueze cu ajutorul osmometrului Pfeffer, dar este greu de obtinut suc celular în cantitati corespunzatoare. De aceea se recurge la procedee indirecte, care pot fi fizice sau biologice. Procedeele biologice utilizeaza material viu, iar cele fizice suc stors din plante (deci nu suc vacuolar pur), care se obtine prin mortificarea materialului si stoarcerea lui. Mortificarea este necesara pentru a se mari permeabilitatea structurilor biologice, astfel ca sa se obtina sucul celular cât mai usor si cât mai nealterat.
Se pregatesc, conform tabelului 1, pornind de la o solutie de zaharoza 1 M, solutii cu concentratiile de 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9 si 1 M, care se iau în volume de câte 10 ml si se pun fiecare în câte o sticla de ceas. Se scufunda apoi în fiecare solutie câte un fragment din epiderma inferioara a frunzelor modificate ale bulbului de ceapa (segmentele de epiderma trebuie sa provina de la aceeasi frunza si de pe aceeasi paralela). Se acopera sticlele de ceas pentru a împiedica evaporatia, se marcheaza concentratiile solutiilor si se lasa în repaus timp de o ora. Se examineaza apoi fiecare fragment din epiderma la microscop (pregatind preparate microscopice obisnuite între lama si lamela, pe lama punându-se solutie în care a stat respectivul material biologic), pentru a depista în care dintre solutii cel putin 50% din celule se gasesc în stadiul de plasmoliza incipienta.
Tabelul 1. Pregatirea solutiilor de zaharoza
|
Solutie zaharoza 1 M (ml) |
|
|
|
|
|
|
|
|
|
|
|
|
Apa distilata (ml) |
|
|
|
|
|
|
|
|
|
|
|
|
Concentratia finala a solutiei de zaharoza (M) |
|
|
|
|
|
|
|
|
|
|
|
Se va constata ca celulele sunt turgescente în cazul solutiilor cu concentratii mai mici, deci hipotonice, în timp ce solutiile mai concentrate în zaharoza (deci hipertonice), celulele sunt plasmolizate (remarcând plasmoliza în diferite faze, în functie de concentratia mediului în care a stat tesutul vegetal).
Exista însa o anumita concentratie la care se va observa o usoara plasmoliza (plasmoliza incipienta). Se poate aprecia prin urmare ca, concentratia interna si externa sunt egale. Aceasta concentratie sau, evident, o concentratie putin mai mica, corespunde concentratiei sucului vacuolar celular.
Calcularea fortei de suctiune sau a presiunii osmotice (în cazul celulelor usor plasmolizate, valoarea fortei de suctiune este egala cu întreaga valoare a presiunii osmotice) se realizeaza dupa rationamentul:
Daca la o solutie 1 M zaharoza ... presiunea osmotica este 22,4 atm
Pentru o solutie 0,3 M .......................presiunea osmotica este x atm
Rezulta ca presiunea osmotica în acest caz este: Po = 22,4 x 0,3/1 = 6,72 atm.
Experienta nr. 23
Masurarea fortei de suctiune a celulelor vegetale
Apa patrunde în celulele vegetale ca si cum ar fi supta de o forta, ce a fost denumita forta de suctiune. Forta de suctiune este determinata de diferenta existenta la un moment dat între presiunea osmotica si presiunea de turgescenta.
Determinarea fortei de suctiune a celulelor vegetale se poate face prin mai multe procedee (procedeul volumetric, procedeul gravimetric, procedeul refractometric, procedeul curentilor).
Procedeul volumetric
Acesta consta în plasarea unor fragmente de organe sau tesuturi într-o serie de solutii cu presiuni osmotice cunoscute, pentru stabilirea solutiei în care volumul materialului vegetal ramâne constant. presiunea osmotica a acestei solutii este egala cu DPD al materialului vegetal si se exprima în atmosfere.
Se iau sase eprubete si se toarna în fiecare din ele câte 10 ml dintr-una din urmatoarele lichide: în prima apa distilata, în a doua o solutie 0,2 M, în a treia o solutie 0,4 M, în a patra o solutie 0,6 M, în a cincea o solutie 0,8 M si în a sasea o solutie 1M zaharoza, care se pregatesc pornind de la o solutie de zaharoza 1M, dupa procedeul prezentat în tabelul 1. Dupa pregatirea solutiilor se agita continutul eprubetelor si se introduce în fiecare dintre ele câte o carota de 30-50 mm lungime, scoasa dintr-un tubercul de cartof. Toate carotele trebuie sa aiba aceeasi lungime si sa fie scoase din acelasi tubercul. Dupa 12 ore de imersie, se scot carotele din solutii, se tamponeaza usor cu hârtie sugativa si se masoara. În solutiile hipotonice lungimea carotelor va fi marita, în cele hipertonice micsorata, iar în solutia izotonica dimensiunea carotei va ramâne constanta. Valoarea fortei de suctiune va fi egala cu presiunea osmotica a solutiei izotonice si se calculeaza cu ajutorul relatiei:
S = CRT,
în care:
S - forta de suctiune a materialului vegetal (în atmosfere);
C - concentratia solutiei izotonice (în moli);
R - constanta gazelor perfecte (0,08207);
T - temperatura absoluta (273 + temperatura de lucru în laborator).
În cazul în care nu se va gasi o solutie izotonica, pentru valoarea lui C din formula se considera media concentratiei (în moli) celor doua solutii învecinate, în care într-una materialul vegetal si-a marit, iar în cealalta si-a micsorat lungimea fata de cea initiala.
Procedeul curentilor (sardakov)
Principiul metodei consta în gasirea unei solutii izotonice cu sucul vacuolar, ceea ce se stabileste urmarind variatia concentratiilor unor solutii în care au stat fragmente de tesut vegetal.
Pentru determinare se iau 10 eprubete. Dintr-o solutie de zaharoza 1 M se fac dilutii de 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8 si 0,9 M (tabelul 1). În fiecare eprubeta se pun câte 10 ml din câte una din solutiile pregatite, iar în ultima, aceeasi cantitate din solutia 1 M. Continutul fiecarei eprubete se împarte în doua, obtinându-se astfel doua siruri de eprubete. În fiecare eprubeta a unui sir se introduce câte un fragment din acelasi tesut vegetal si se lasa 20-30 de minute, dupa care se pune câte o picatura de albastru de metilen. Apoi, cu câte o pipeta capilara se ia din fiecare eprubeta din al doilea sir câte o coloana de 14-15 cm de lichid colorat si i se da drumul cu atentie unei picaturi în centrul eprubetei corespunzatoare din primul sir. La concentratiile mari, hipertonice, care s-au diluat în urma schimbului osmotic cu tesutul si si-au micsorat densitatea, se vor observa curenti ascendenti de lichid colorat. La eprubetele cu solutii hipotonice se vor observa curenti descendenti. În eprubeta în care solutia este izotonica cu sucul vacuolar din tesut, lichidul colorat introdus în solutia initiala va ramâne pe loc.
Pornind de la valoarea concentratiei acestei solutii, se poate calcula forta de suctiune a tesutului dupa formula:
P=CRT, unde, P= forta de suctiune, C= concentratia solutiei izotonice cu sucul celular, R= constanta gazelor perfecte (=0,08207), T= 273+ temperatura de lucru în laborator.
Forta de suctiune a diferitelor tesuturi vegetale mai poate fi determinata cu ajutorul procedeului refractometric, al procedeului Ursprung si Blum, prin psichrometrie, prin metoda crioscopica, prin utilizarea camerei de presiune.
Care este importanta fenomenelor de plasmoliza si deplasmoliza în cazul aprovizionarii cu apa a plantelor?
Descrieti starea de turgescenta a celulei vegetale!
Calculati forta de suctiune a diferitelor tesuturi vegetale!
|