ANTIBIOTIQES ANTIBACTERIENNES
DEFINITION
Les antibiotiques se définissent comme des molécules capables d'inhiber la croissance ou même de tuer les bactéries, sans affecter l'hôte (cellules eucaryotes).
Les sources principales d'antibiotiques sont les champignons, mais parfois aussi les bactéries. Il existe égalemet depuis un certain nombre d'années des antibiotiques entièrement synthétiques.
La pénicilline, premier antibiotique à
usage clinique, est produite par Penicillum notatum et sa découverte
fortuite résulte de l'observation par Fleming du pouvoir inhibiteur d'une
colonie de ce champignon vis-à-vis de Staphylococcus aureus lors d'une contamination
accidentelle d'une plaque de Petri.
On a longtemps cru que la production d'antibiotiques par des champignons était un moyen pour ceux-ci de se protéger contre l'infection bactérienne. Sans nier ce rôle potentiel, on sait maintenant que les microorganismes en général produisent de nombreuses molécules à action pharmacologique très variable. Cette production de molécules sans intérêt apparent résulterait d'une potentialité des microorganismes d'"essayer" des synthèses très variées (métabolites secondaires), jusqu'au moment où une des molécules obtenues leur confère un avantage dans le milieu où ils se développent. Cette notion a été mise à profit avec succès pour isoler de sources naturelles variées un très grand nombre de molécules d'intérêt majeur en médecine.
Au départ de molécules naturelles, cependant, des modifications chimiques sont souvent apportées pour améliorer l'activité et/ou modifier des paramètres pharmacocinétiques essentiels. Aujourd'hui, la plupart des antibiotiques en usage clinique sont donc obtenus par semi-synthèse. Récemment cependant, les progrès de la chimie ont permis de réaliser dans des conditions économiques satisfaisantes la synthèse totale de plusieurs d'entre eux.
CLASSIFICATION (CRITERE CHIMIQUE)
Betalactames
Fosphonates
Lincosamides
Macrolides
Glicopeptides
Aminoglycosides
Tetracyclines
Phenicoles
Varia : rifamycines, polipeptides, fusidanines, coumarines, sinergistines, ciclotialidines, oxazolidinones, quinolones*
* Les quinolones ont ete etudie dans le group de chimiotherapiques antibacteriennes.
CIBLES BACTERIENNES DES ANTIBIOTHIQUES
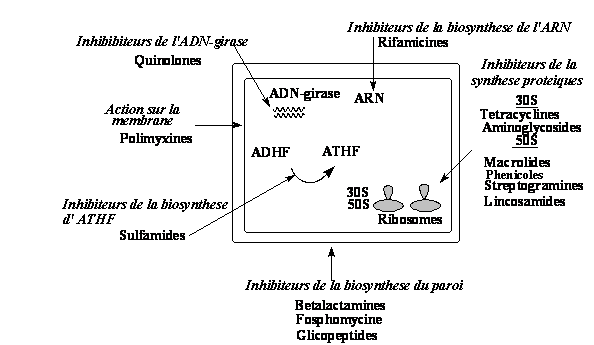
1. Inhibiteurs de la biosynthese du paroi
Les cellules eucaryotes animales ne possèdent pas de paroi. Les bactéries par contre sont entourées d'une coque en peptidoglycan, polymère de sucres réticulé par des ponts de nature peptidique. Plusieurs classes d'antibiotiques prennent pour cibles des enzymes intervenant dans la synthèse de cette paroi.
Le constituent principale du paroi bacterienne est le peptidoglican (mureine). Le peptidoglycan (PG) est un polymère qui constitue un réseau tridimensionnel entourant complètement la bactérie.
Il constitue un caractère original et constant
du monde bactérien.
Le PG est constitué par la polymérisation d'unités disaccharide-peptide
(disaccharides = résidu N-acétylglucosamine et résidu d'acide
N-acétylmuramique; peptide = chaîne pentapeptidique).
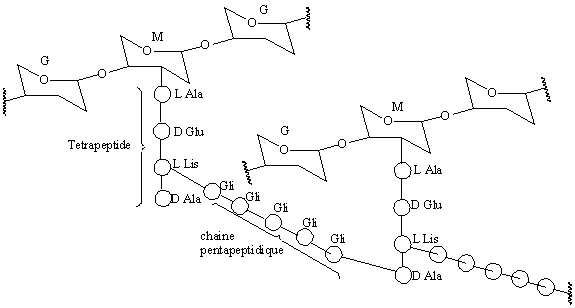 La
structure du peptidoglican
La
structure du peptidoglican
La
biosynthèse du PG fait intervenir de nombreuses réactions que l'on peut
regrouper en 3 étapes:
(1) élaboration des précurseurs du PG, au niveau du cytoplasme;
(2) transport de ces précurseurs au travers de la membrane cytoplasmique;
(3) incorporation des unités de disaccharides-pentapeptide sur le squelette du
PG existant, à la face externe de la membrane cytoplasmique
2. Antibiotiques actifs sur la synthèse protéique
Les
ribosomes procaryotes ne sont pas constitués des mêmes protéines que les
ribosomes eucaryotes, et ont d'ailleurs des coefficients de sedimentation différents:
- 70S pour les ribosomes procaryotes (50S pour la sous-unité lourde et 30S pour
la sous-unité légère)
- 80S pour les ribosomes eucaryotes (60S pour la sous-unité lourde et 40S pour
la sous-unité légère)
Il existe des inhibiteurs:
- De la sous-unité 50S, qui empêchent la fixation d'un nouvel acide aminé sur
la chaîne en croissance (phénicolés) ou le transfert de la
chaîne en croissance (macrolides, lincosamides,
streptogramines).
- De la sous-unité 30S, qui empêchent ou perturbent la liaison des
aminoacyl-ARNt aux ribosomes (tétracyclines, aminoglycosides
RESISTANCE BACTERIENNE AUX ANTIBIOTIQUES
La resistance aux antibiotiques este un phenomene general, observe pour toutes les especes bacterienne rencontrees chez l'homme et plus particulier : Staphylococcus aureus, Enterococcus, Streptococcus pneumoniae, Pseudomonas aeruginosa, Mycobacterium tuberculosis.
Il existe 2 type de resistence:
-naturelle-presente dans toutes les souches de l'espece consideree et preexistente a l'usage des antibiotiques.
-acquise-n'est presente que chez quelques souches d'une espece normalement sensible et apparait etroitement liee a l'utilisation des antibiotiques.
Causes du developpement de la resistence
-la prescription a grande echelle et parfois impropre d'antibiothiques.
-la contamination de la viande des animaux avec antibiothiques qui sont utilise en milieu veterinaire comme promoteur de la croissance soit comme therapeutiques.
Mecanismes de resistance bacterienne aux antibiotiques
|
Antibiotique |
Mecanisme de rezistance |
|
Beta-lactames (Penicilines, Cephalosporines, etc.) |
Inactivation enzimatique (betalactamase) Alteration du PBP Impermeabilisation |
|
Glicopeptides |
Alteration du cible |
|
Macrolides |
1. Alteration du cible 2. Eflux |
|
Lincosamides |
Alteration du cible |
|
Phenicoles |
Inactivation enzimatique (cloramphenicol-acetiltransferase) |
|
Tetracyclines |
1. Eflux 2. Alteration du cible |
|
Aminoglicosides |
Inactivation enzimatique |
PBP-penicillins binding proteins (role de recepteur pour les betalactames)
Exemple: la resistance aux betalactames
Une imperméabilisation par altération des porines se rencontre chez les Gram (-) et confère une résistance aux beta-lactames trop hydrophiles pour diffuser à travers la membrane externe (céphalosporines; pénicillines à large spectre).
Porines=canaux par lesquells les betalactames penetrent dans la cellule bacterienne

Mode de penetration de betalactames dans la cellule
Une altération des PBP peut réduire leur affinité pour les beta-lactames. Ce type de mécanisme - développé au niveau de la PBP2 - se retrouve dans les souches de staphylocoques dites "résistantes à la méthicilline" (MRSA). Cette altération entraîne une résistance à l'ensemble de la classe des beta-lactames et a donc une grande importance clinique.
La production par les bactéries d'enzymes hydrolysant l'antibiotique constitue le mécanisme de résistance le plus courant.
Ces enzymes sont secrétés au dehors dans le cas des Gram (+), mais maintenus dans l'espace périplasmique dans le cas des Gram (-).
Il s'agit de protéases à sérine active (Enz-Ser-OH), qui se lient aux beta-lactames avec plus d'affinité que les PBP. Comme les PBP, elles hydrolysent la liaison amide du cycle beta-lactame, pour former un acyl enzyme, mais la différence majeure entre les 2 types d'enzymes consiste dans la vitesse avec laquelle l'acylenzyme est hydrolysé. En effet, si les PBP ne sont capables d'hydrolyser qu'une beta-lactame par heure de tel sorte que l'acylenzyme apparaît dans ce cas comme un intermédiaire stable, les beta-lactamases les plus efficaces en hydrolysent 1000 par seconde, rendant l'antibiotique totalement inactif et régénérant l'enzyme pour une nouvelle réaction d'hydrolyse.
|
1. Beta-lactames substrats des transpeptidases: inactivation de l'enzyme |
|
|
|
2. Beta-lactames substrats des beta-lactamases: inactivation de l'antibiotique |
|
|
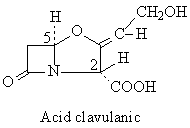
L'importance du mode de résistance associée à la production de beta-lactamases a conduit à la synthèse de molécules résistantes à ces enzymes. Les beta-lactamases, cependant, se caractérisent par une plasticité extraordinaire, de telle sorte qu'elles finissent toujours par parvenir à hydrolyser les nouveaux antibiotiques. Une autre stratégie consiste dès lors dans la mise au point d'inhibiteurs de beta-lactamases (sulbactam, tazobactam, acide clavulanique). Ces molécules, de structure voisine aux beta-lactames (noyau clavane), lient de façon irréversible la beta-lactamase, empêchant son action ultérieure sur l'antibiotique coadministré.
Depuis la découverte de la pénicilline par Fleming en 1929, de nombreuses beta-lactames (pénicillines, céphalosporines, etc.) ont été obtenues, d'abord par fermentation, puis par hémisynthèse. Tous ces antibiotiques présentent un mode d'action commun, mais se distinguent par le spectre, la sensibilité aux mécanismes de résistance, la pharmacocinétique ou la tolérance.
Malgré une structure de base commune (le cycle beta-lactame), on distingue plusieurs familles de beta-lactames en fonction de la nature du cycle accolé (pénicillines, céphalosporines, carbapénèmes, monobactames).
En mimant la structure tridimensionnelle de la séquence D-Ala-D-Ala, les beta-lactames se comportent comme des inhibiteurs de la transpeptidase, enzyme essentiel à la synthèse de la paroi bactérienne. Etant donné qu'elles forment un lien covalent avec l'enzyme et empêchent donc toute activité de celui-ci, les beta-lactames sont appelées substrat-suicide.
L'effet
bactéricide des beta-lactames s'explique par l'activation successive d'enzymes
lytiques appelés autolysines.
|
Diversité des antibiotiques de type beta-lactames: principaux cycles et antibiotiques représentatifs |
|
|
Le cycle betalactamique est donc commune pour toutes les betalactames, sa integrite soyant indispensable pour l'activite antibacterienne.
1. PENICILLINES
Structure chimique generale
L'acide 6-aminopénicillanique (cycle thiazolidine lié au cycle beta-lactame) est le noyau de base des pénicillines. Il peut être substitué par acylation sur sa fonction aminée pour donner naissance à des dérivés qui se distinguent par la stabilité, la pharmacocinétique, le spectre et la résistance aux beta-lactamases. Par ailleurs, la fonction carboxylique peut être transformée en carboxylate (plus soluble) ou permettre l'obtention d'esters (prodrogues). Cette fonction acide est toutefois essentielle à l'activité antibactérienne (elle fait partie du pharmacophore).
|
|
Sur base de la nature des substituants et de ses conséquences pour l'activité antibiotique, on peut distinguer plusieurs classes de produits, qui seront comparées systématiquement par la suite
Classification (critere mode d'obtention)
-Penicillines naturelles
-Penicillines de semisynthese
1.1.Penicillines naturelles
L'espece Penicillium produit 6 penicillines naturelles : G, F, K, N, X, V. Seules penicillines G et V sont utilisees en therapeutique:

Les penicillines G et V s'obtient par voie fermentative (biosynthese dirige). La souche productrice est Penicillium chrysogenum qui utilise 2 acides amines pour la byogenese du noyau penam : cysteine et valine.
Dans la biosynthese dirige, s'utilise comme precurseurs de la chain laterale l'acide fenilacetique pour la penicilline G), ou acide fenoxiacetique pour la penicilline V.
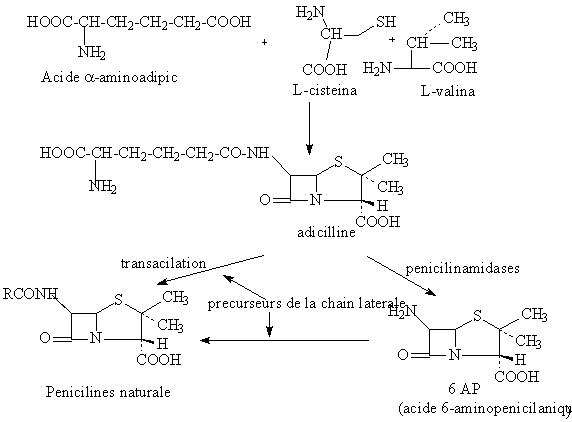
Schema de la biosynthese dirigee des penicillines naturelles
Stabilite des penicillines naturellse
-la penicilline G est instable en millieu acide. Donc, elle s'utilise seulement par voie parenterale (iv ou im).
-la penicilline V est stable en millieu acide; elle s'uitilise par voie orale
-tous les penicillines sont instable en milieu basique et en presence de l'alcohol.
-en presence des hydroxides, les penicillines soufrent une reaction de hydrolise au niveau du betalactame, avec la formation d'acide peniciloique, inactiv:

1.2.Penicillines retard
Pour assurer une duree d'action plus grande, ont ete obtenu des penicillines retard, qui sont des sels de la penicilline G avec des amines organique qui s'utilise par voie im.
A cette groupe appartient la procaine-penicilline G et la benzatine-penicilline G.
procaine-penicilline G
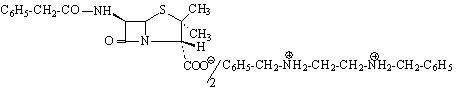
benzatine-penicilline
G.
1.3.Penicillines de semisynthese
Sont les plus nombreuses penicillines.
Obtention
La semisynthese des penicillines comporte 2 etapes:
a.Obtention de l'acide 6-aminopenicilanique
b.Acylation de l'acide 6-aminopenicilanique
a. Obtention 6-AP
a.1.-enzimatique: sous l'action du penicillin-amidase, les penicillines naturelles se hidrolisent au niveau du reste acylant de la chaine lateralle, avec l'obtention du 6-AP:
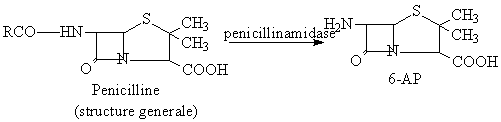
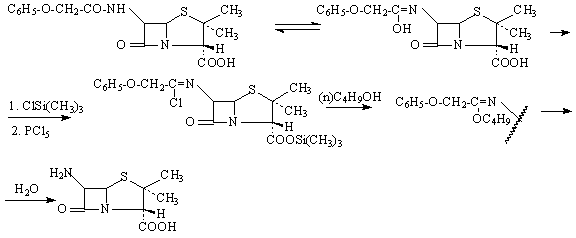
a.2.-chimique: sous l'action de la clorure de trimethylsilil et pentaclorure de phosphor, la penicilline V se transforme dans une iminoclorure protégé au niveau du carboxyl sous forme de trimethyle-sililesther. Par la reaction aves n-buthanol, l'iminochlorure se transforme dans une iminoether qui hidrolise au 6-AP.
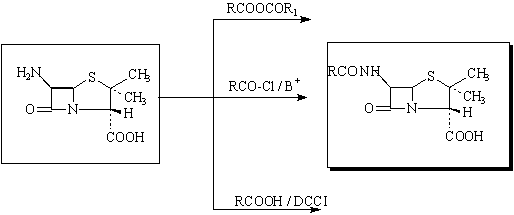
b.Acylation de l'acide 6-aminopenicilanique
Se realise avec des anhydrides mixtes, clorures d'acides ou acides carboxiliques en presence de diciclohexylcarbodiimide.
Clasification. Aspects structurales
1.3.1. Penicillines resistantes au suc gastrique: fenoximethylpenicillines
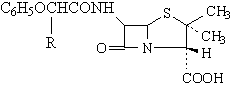
|
R |
DCI |
|
CH3 |
Phenetycilline |
|
C2H5 |
Propycilline |
Penicillines resistantes au betalactamases: methycilline , isoxazolilpenicillines
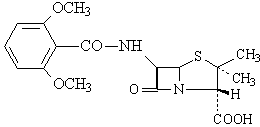
methycilline
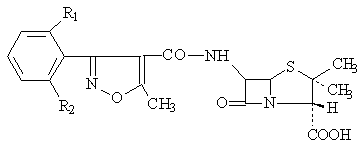
Isoxazolilpenicillines
|
R1 |
R2 |
DCI/Administrare |
|
H |
H |
Oxacilline |
|
H |
Cl |
Cloxacilline |
|
Cl |
Cl |
Dicloxacilline |
|
Cl |
F |
Flucloxacilline |
1.3.3. Penicillines a spectre large
- aminobenzylpenicillines,
-carboxipenicillines,
- ureidopenicillines
Aminobenzylpenicillines Ampicilline, proampicillines,analogues de l'ampicilline
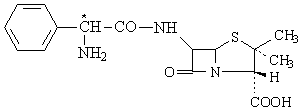
Ampicilline
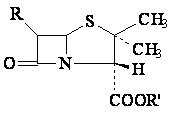
Proampicillines
-proampicillines obtenues par le ,,blocage'' de l'amine
|
DCI |
R |
R' |
|
Metampicilline |
|
Na |
|
Hetacilline |
|
K |
-proampycillines obtenues par esterification du carboxyl
|
DCI |
R |
R' |
|
Pivampicilline |
|
(pivaloil-oximethyl ester) |
|
Bacampicilline |
|
(carboxilat-oxiethyl ester) |

Amoxicilline
Les proampicillines et amoxicilline ont une absorbtion orale superieure a l'ampicilline, le meme spectre antibacterienne et les memes indications
Carboxipenicillines
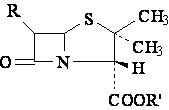
|
DCI |
R |
R' |
|
Carbenicilline |
|
Na |
|
Ticarcilline |
|
Na |
Ureidopenicillines(acylureidopenicillines)

|
DCI |
R |
R' |
R1 |
|
Azlocilline |
|
Na |
|
|
Mezlocilline |
Na |
|
|
Piperacylline |
|
Na |
- |
Relations structure-activite
|
Nature des substituants et activité antibiotique: exemples |
|||
|
Type de pénicilline(s) |
Molécule(s) |
Chaîne latérale |
Caractéristique(s) |
|
Sensibles aux pénicillinases |
Pénicilline V |
Phénoxyméthyl: Affinité pour les électrons |
Molécule plus résistante à l'acidité gastrique |
|
Résistantes aux pénicillinases |
Méthicilline |
Chaine latérale volumineuse et lipophile, groupements méthoxy |
Protection de l'hydrolyse par les pénicillinases des staphylocoques |
|
Oxa-, cloxa-, dicloxa-, flucloxa-cilline |
Groupement isoxazolyl |
Résistance aux pénicillinases et à l'acidité grastrique |
|
|
Aminopénicillines |
Ampicilline, amoxicilline |
Addition d'un groupe amino à la benzylpénicilline |
Résistance à l'acidité gastrique |
|
Carboxypénicillines et acyluréidopénicillines (pénicillines anti-pseudomonales) |
Ticarcilline, carbénicilline, pipéracilline,... |
Chaine latérale hydrophile |
Amélioration de la pénétration dans les bactéries Gram (-) |
Spectre d'activité et indications thérapeutiques
|
Spectre d'activité et grandes indications des différentes pénicillines |
||
|
Classe |
Spectre |
Indications |
|
Benzylpénicillines |
Gram (+), anaérobes, certains Gram (-) |
- Infections à germes Gram (+) non
producteurs de beta-lactamases (streptocoques, Neisseria meningitidis) |
|
Pénicillines résistantes aux beta-lactamases |
Germes couverts par les
benzylpénicillines |
Infections à germes Gram (+) producteurs de beta-lactamases (staphylococcies de la peau, des muqueuses et de la sphère ORL en monothérapie) |
|
Aminopénicillines |
Germes couverts par les
benzylpénicillines |
- Comme la pénicilline (avantage
pharmacocinétique) |
|
Carboxypénicillines et uréidopénicillines |
Spectre réduit envers les Gram (+)* |
Infections sévères à Gram (-), et notamment celles à Pseudomonas (souvent en association avec un aminoglycoside) |
|
* Ceci est surtout vrai pour la temocilline dont l'activité est nulle sur les Gram (+) et dans une certaine mesure également pour la carbénicilline et la ticarcilline. La pipéracilline conserve une bonne activité sur les Gram (+) |
Posologie
Etant donné que le paramètre déterminant l'activité des beta-lactames est le temps pendant lequel leur concentration au site d'infection est supérieure à leur CMI, toutes les pénicillines devront être administrées à intervalles réguliers (4 à 6 x/jour).
Il existe cependant des formulations qui permettent une libération lente d'antibiotique, et donc un espacement des doses: pénicille G-procaïne (couverture de 12 à 24 heures); pénicilline G-benzathine (2 à 4 semaines), après injection intramusculaire.
|
Posologie des principales pénicillines chez l'adulte avec une fonction rénale normale |
|||
|
Pénicilline |
Voie d'administration |
Posologie usuelle (/jour) |
Posologie journalière maximale |
|
1. Benzylpénicillines |
|||
|
Pénicilline G (Penicilline) |
iv-im |
1-4Mio |
30Mio (6x5) |
|
Pénicilline V (Peni-Oral, Oracilline) |
po |
4x1Mio | |
|
2. Pénicillines résistantes aux pénicillinases |
|||
|
Cloxacilline (Penstaphon, Orbenin) |
po |
4x500mg |
4x2g |
|
Oxacilline (Penstapho) |
im-iv |
4x500mg |
6x2g |
|
Flucloxacilline (Floxapen-Staphycid) |
po |
4x500mg |
4x2g |
|
3. Aminopénicillines |
|||
|
Ampicilline (Pentrexyl - Penbritin) |
Po-im-iv |
4-6x500mg |
4g |
|
Amoxycilline (Clamoxyl - Flemoxin - ...) |
po |
4x500mg |
12g |
|
Bacampicilline (Penglobe - Bacampicin) |
po |
3x400mg |
2.4g |
|
4. Carboxypénicillines et acyluréidopénicillines |
|||
|
Témocilline (Negaban) |
im-iv |
2x1-2g |
4g |
|
Pipéracilline-tazobactam (Tazocin) |
im-iv |
3-4x2g/250mg |
3-4x4g/500mg |
Effets secondaires
Les pénicillines sont généralement bien tolérées, même à forte dose. Elles sont cependant la cause de réactions allergiques graves, voire mortelles. Celles-ci trouvent leur origine dans l'instabilité chimique relative des pénicillines. Leurs produits de dégradation (pénicilloyl-) se lient de façon covalente aux protéines plasmatiques et constituent ainsi des haptènes.
|
Pénicillines et réactions allergiques |
|
|
1. Réactions immédiates |
- Dans les minutes qui suivent
l'administration |
|
2. Réactions accélérées |
- Dans les heures qui suivent
l'administration (1-72h) |
|
3. Réactions tardives |
- Plus de 72h après l'administration |
|
Réactions allergiques croisées avec les autres beta-lactames |
|
- Les patients allergiques à la
pénicilline doivent être considérés comme étant allergiques à toutes les
pénicillines semi-synthétiques. |
Les
inhibiteurs de beta-lactamases sont des dérivés de l'acide clavulanique et de
l'acide pénicillanique, qui possèdent une activité bactérienne intrinsèque
faible, mais sont de puissants inhibiteurs de beta-lactamases, restaurant ainsi
l'activité de la beta-lactame qui leur est associée.
Les inhibiteurs de beta-lactamases sont des substrats-suicide qui se lient de
manière irréversible à la beta-lactamase, empêchant son action ultérieure sur
les beta-lactames.
Representants
Acide clavulanic Streptomyces clavuligericus
Penicilat sulfones
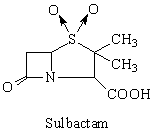
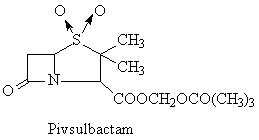
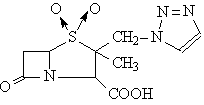
Tazobactam
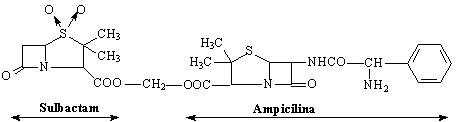
Sultamycilline
L'association peut être administrée par voie orale ou parentérale et possède des propriétés pharmacocinétiques similaires à celles de l'amoxycilline seule. Sa tolérance est bonne. Les indications de cette association sont principalement les otites moyennes aiguës, les infections des voies respiratoires inférieures, les infections urinaires et les autres infections par des germes résistants à l'amoxycilline seule.
L'association est réservée à l'usage parentéral. Elle est utilisée pour le traitement des infections pulmonaires, urinaires, intra-abdominales et gynécologiques.
Le sulbactam possède une pharmacocinétique
similaire à
Eliminé par voie rénale, le tazobactam voit
sa clairance rénale diminuée par la coadministration de pipéracilline. Cette
interaction permet d'obtenir une élimination parallèle des deux molécules.
Toutefois, en cas d'insuffisance rénale, l'élimination de tazobactam sera
réduite. Le tazobactam pénètre dans le LCR quand les méninges sont enflammées.
En raison de la bonne activité intrinsèque et du large spectre de la
pipéracilline, l'association avec le tazobactam est potentiellement très utile
dans le contrôle des infections graves (en particulier dans le traitement
d'infections à germes résistants contractés en milieu hospitalier) localisées
dans divers territoires (poumons, abdomen, peau et tissus mous, os) ainsi que
dans les septicémies ou chez les patients neutropéniques.
RESUME
- La structure de base des pénicillines est constituée d'un noyau beta-lactame
et d'un noyau thiazolidine.
- Sur base de la nature des substituants et du spectre antibiotique, on
distingue 4 sous-groupes de pénicillines: (1) les benzylpénicillines(peniclillines
naturelles G et V); (2) les pénicillines résistantes aux pénicillinases; (3)
les aminopénicillines; (4) les pénicillines anti-pseudomonales
(carboxypénicillines et acyluréidopénicillines). Les sous-groupes 2,3 et 4 sont
des penicillines de semisynthese.
- Les indications
thérapeutiques varient suivant le sous-groupe considéré.
- Afin de maintenir une activité envers les bactéries productrices de
beta-lactamases et donc d'élargir le spectre, certaines pénicillines sont
associées à des inhibiteurs de beta-lactamases, tels que l'acide clavulanique
et le tazobactam.
- La pénicilline G et les pénicillines anti-pseudomonales s'administrent par
voie parentérale. Les autres pénicillines peuvent être administrées par voie
orale. De manière générale les pénicillines sont éliminées par voie rénale, et
présentent une demi-vie courte. Le temps pendant lequel la concentration
sérique se situe au-delà de la CMI est le paramètre d'efficacité essentiel, ce
qui explique une nécessité d'administration fréquente des pénicillines.
- L'effet secondaire principal des pénicillines, et le plus redouté, est
l'allergie médiée par les IgE.
2. CEPHALOSPORINES
2.1. Structure chimique
Les céphalosporines ont pour noyau commun l'acide 7-aminocéphalosporanique. Par rapport à l'acide 6-aminopénicillanique, ce noyau possède un carbone supplémentaire, mais la distance séparant la fonction carboxylique de l'amide cyclique reste conservée.
|
|
Structure. Nomenclature
- La structure de base des cephalosporines est constituée d'un noyau beta-lactame lie a un noyau dihydrothiazine=cephem
Clasification des cephemes (critere structurale)
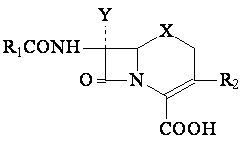
Cephemes-structure generale
|
X |
Y |
Cepheme |
|
S |
H |
Cephalosporines |
|
S |
OCH3 |
Cephamycines |
|
O |
H |
Oxacephalosporines |
|
CH2 |
H |
Carbacephemes |
2.2.Nomenclature
-IUPAC: acides (6R,7R) 7-acylamino-3R2-8-oxo-1-aza-5-tia-biciclo [4,2,0] oct-2-en-2-carboxiliques;
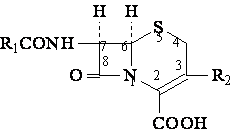
-apres Morin: acides (6R,7R)-3-R2-7-acylamino-cephem-4 carboxiliques.
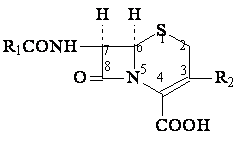
2.3. Clasification des cephalosporines (critere mode d'obtention):
-cephalosporines naturelles: Cephalosporine C-(sans interet pour la therapeutique)
-cephalosporines de semisynthese (4 generations)
2.4. Obtention des cephalosporines de semisynthese
2 etapes
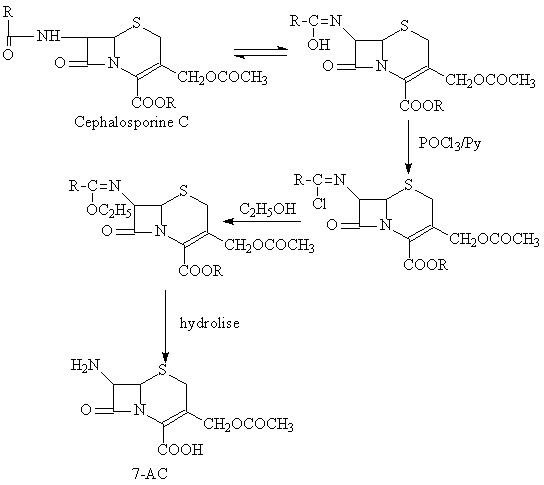
a. Obtention de l'acide 7-aminocephalosporanique(7-AC)
b. Acylation du 7-AC et modulation au C3
a.Obtention de l'acide 7-aminocephalosporanique(7-AC)
Procede du Morin-utilise comme matiere premiere la cephalosporine C
b. Acylation et modulation au C3
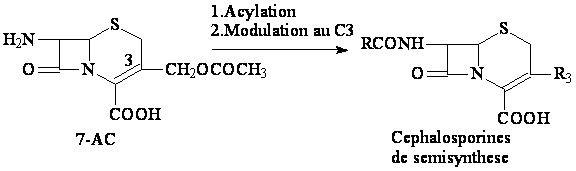
L'acylation: clorure d'acydes/piridine; R-COOH/DCCI; anhydrides d'acydes carboxiliques
2.5.Cephalosporines de semisynthese. Representants
La classification en 4 generation a ete realise selon les criteres suivantes:
-spectre d'activite
-sensibilite au betalactamase
-concentration minime inhibitrice sur les enterobacteriaes
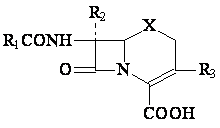
|
DCI |
R1 |
R2 |
R3 |
X |
|
Cephalotine (FRX) |
|
H |
-CH2OCOCH3 |
S |
|
Cephacetrile |
|
H |
-CH2OCOCH3 |
S |
|
Cefapyrine |
|
H |
-CH2OCOCH3 |
S |
Cephalosporines avec des fragments heterocycles en 3 et en chaine laterale (usage parenterale)
|
DCI |
R1 |
R2 |
R3 |
X |
|
Cefaloridine |
|
H |
|
S |
|
Cefazoline |
|
H |
|
S |
|
DCI |
R1 |
R2 |
R3 |
X |
|
Cefradine |
|
H |
-CH3 |
S |
|
Cefalexine |
|
H |
-CH3 |
S |
|
Cefadroxil |
|
H |
-CH3 |
S |
|
Cefaclor* |
|
H |
-Cl |
S |
|
Cefatrizine |
|
H |
|
S |
|
DCI |
R1 |
R2 |
R3 |
X |
|
Cefamandole |
|
H |
|
S |
3-Carbamoil-oximethylcephalosporines
|
DCI |
R1 |
R2 |
R3 |
X |
|
Cefoxitine |
|
OCH3 |
CH2-O-CONH2 |
S |
|
Cefuroxime |
|
H |
CH2-O-CONH2 |
S |
|
DCI |
R1 |
R2 |
R3 |
X |
|
Cefsulodine |
|
H |
|
S |
Oxacephalosporines
|
DCI |
R1 |
R2 |
R3 |
X |
|
Latamoxef |
|
-OCH3 |
|
O |
2-aminothyazolil-cephalosporines
|
DCI |
R1 |
R2 |
R3 |
X |
|
Cefotiam |
|
H |
|
S |
2-aminothyazolil-alcoximinocephalosporines
|
DCI |
R1 |
R2 |
R3 |
X |
|
Cefotaxime |
|
H |
|
S |
|
Ceftizoxime |
|
H |
H |
S |
|
Ceftazidime |
|
H |
|
S |
|
Cefixime |
|
H |
-CH=CH2 |
S |
|
Ceftriaxone ROCEPHINE |
|
H |
|
S |
Ureidocephalosporines
|
DCI |
R1 |
R2 |
R3 |
X |
|
Cefoperazone |
|
H |
|
S |
Cephamycines(metoxicephalosporines)
|
DCI |
R1 |
R2 |
R3 |
X |
|
Cefotetan |
|
OCH3 |
|
S |
IVeme generation
|
DCI |
R1 |
R2 |
R3 |
X |
|
Cefpirone |
|
H |
|
S |
|
Cefepime |
|
H |
|
S |
Esters des cephalosporines
Some cephalosporines de II-eme et III-eme generations ont ete transforme en double esters, pour obtenir des nouvelles cephalosporines d'usage orale: cefuroxime axetil, cefpodoxime proxetil et cefotiam hexetil.
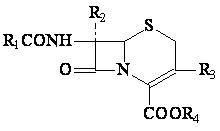
|
DCI |
R1 |
R2 |
R3 |
R4 |
|||
|
II-eme generation |
|||||||
|
Cefuroxime axetil |
|
H |
CH2OCONH2 |
|
|||
|
III-eme generation |
|||||||
|
Cefpodoxime-proxetil |
|
H |
CH2OCH3 |
|
|||
|
Cefotiam-hexetil |
|
H |
|
|
|||
Axetil= metil-oxi-carbonil-oxi-etil;
Proxetil=izopropil-oxi-carbonil-oxi-etil;
Hexetil=ciclohexil- oxi-carbonil-oxi-etil.
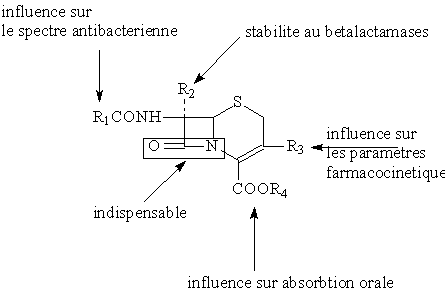
2.6. Relations structure-activite-proprietes pharmacocinetiques
2.7. Spectre d'activité et indications thérapeutiques
La classification des céphalosporines repose davantage sur leur spectre d'action de plus en plus large que sur une structure chimique commune. On les répertorie de façon quelque peu arbitraire en générations successives.
|
Spectre d'activité et grandes indications des différentes générations de céphalosporines |
||
|
Céphalosporines |
Spectre |
Indications |
|
Première generation |
- Coques Gram
(+) sauf MRSA ex E. coli, K. pneumoniae, P. mirabilis |
- Infections à
Gram (+) sensibles (et certaines infections communautaires à Gram (-)) |
|
Deuxième generation |
- Spectre
élargi vers les Gram (-), en particulier Proteus et Enterobacter; |
- Otites ou
sinusites à Haemophilus |
|
Troisième génération |
- Spectre
élargi vers les Gram (-) |
- Infections
sévères à Gram (-) (souvent un premier choix), y compris les infections
méningées (bonne diffusibilité à travers la barrière hémato-encéphalique) |
|
Quatrième generation |
- Gram (-), y
compris Pseudomonas |
- Pourraient remplacer les céphalosporines de 3e génération pour le traitement des infections à germes résistants (actives sur les souches résistantes aux céphalosporines de 3e génération, résistent aux beta-lactamases, peu inductrices de beta-lactamases) |
Toutes générations confondues, les céphalosporines sont dépourvues d'activité sur Enterococcus, Listeria et Legionella.
2.8.Posologie
Etant donné que le paramètre déterminant l'activité des beta-lactames est le temps pendant lequel leur concentration au site d'infection est supérieure à leur CMI, toutes les pénicillines devront être administrées à intervalles réguliers. A part la ceftriaxone qui possède une demi-vie plus longue, ces médicaments demandent des administrations répétées.
|
Posologie des principales céphalosporines chez l'adulte avec une fonction rénale normale |
|||
|
Céphalosporine |
Voie d'administration |
Posologie journalière usuelle |
Posologie journalière maximale |
|
Première génération |
|||
|
Cefadroxyl (Duracef, Moxacef) |
po |
4x500mg |
4x1g |
|
Cefalexine (Ceporex, Keforal) |
po |
4x750mg |
4x1g |
|
Cefatrizine (Cefaperos) |
po |
2-3x500mg | |
|
Cefazoline (Cefacidal, Kefzol) |
iv, im |
3x1g |
3x2g |
|
Cefradine (Velosef) Cefaclor (Ceclor) |
iv, im po |
4x500mg 3x250-500mg |
4x1g 4x1g |
|
Deuxième génération |
|||
|
Cefamandole (Mandol) |
iv, im |
3-6x0.5-1g |
4-6x1g |
|
Cefoxitine (Mexofin) |
iv, im |
3-4x1g |
3-4x2g |
|
Cefuroxime (Zinacef) |
iv, im |
3x1.5g |
4x1.5g |
|
Cefuroxime axetil (Zinnat) |
po |
2x0.25-0.5g |
2x0.5g |
|
Cefonicide (Monocid) |
iv, im |
1x1g | |
|
Troisième génération |
|||
|
Cefotaxime (Claforan) |
iv, im |
4x1g |
6x2g |
|
Ceftazidime (Glazidim, Kefadim) |
iv, im |
3x1g |
4x2g |
|
Ceftriaxone (Rocephin) |
iv, im |
1x1g |
1x2g |
|
Cefotetan (Apacef) |
iv, im |
2x1g |
2x2g |
|
Quatrième génération |
|||
|
Cefepime (Maxipime) |
iv, im |
2x1g |
2-3x2g |
|
Cefpirome (Cefrom) |
iv, im |
2x1g |
2x2g |
Les
céphalosporines sont peu toxiques. Elles sont responsables d'une
hypersensibilité, qui peut être croisée avec l'allergie aux pénicillines et qui
procède du même mécanisme. Les réactions précoces et les réactions anaphylactiques
médiées par les IgE sont cependant plus rares, surtout pour les dérivés de la
2e et 3e génération. Les céphalosporines de 1ère génération ne devraient pas
être administrées en cas d'allergie à la pénicilline.
Les céphalosporines peuvent favoriser l'apparition d'une phlébite au site
d'injection.
Certaines
céphalosporines présentent en outre des effets secondaires particuliers:
- Toxicité rénale pour la cefaloridine
- Colite pseudomembraneuse par surinfection à Clostridium difficile
(surtout pour la cefoperazone)
- Pour les dérivés porteurs d'un radical thiométhyltétrazole (latamoxef,
cefamandole, cefoperazone, cefotetan): effet antabuse et hypoprothrombinémie
(liée soit à une diminution de syntèse de facteurs de la coagulation vitamine-K
dépendants, soit à une destruction de la flore intestinale responsable de la
synthèse de la vitamine K).
Cephalosoprines-Notions essentielles
-La structure chimique de base des céphalosporines est constituée d'un noyau beta-lactame et d'un noyau dihydrothiazine.
-On distingue à l'heure actuelle 4 générations de céphalosporines. Les céphalosporines de 1ère génération ont un spectre essentiellement dirigé vers les Gram (+), et ce spectre s'élargi vers les Gram (-) dans les générations suivantes.
-Les céphalosporines de 1ère génération constituent un premier choix dans la prophylaxie chirurgicale. Les céphalosporines de 2e génération sont utilisées dans un grand nombre d'infections, notamment respiratoires, urinaires, ostéoarticulaires. Les céphalosporines de 3e et 4e génération sont utilisées dans le traitement d'infections sévères à Gtam (-), y compris Pseudomonas.
-L'émergence de résistances aux céphalosporines de 3e génération pose actuellement problème en milieu hospitalier
-De nombreuses céphalosporines ne sont pas résorbées par voie orale et doivent donc être administrées par voie parentérale. Comme pour les pénicillines, les céphalosporines présentent une courte demi-vie (à l'exception de la ceftriaxone), et doivent être administrées de façon régulière. Ceci est d'autant plus important que le principal paramètre d'efficacité est le temps au delà duquel la concentration sériques est maintenue au-delà de la CMI.
-Il existe un risque de sensibilité croisée avec les pénicillines.
3. MONOBACTAMES
Structure chimique
Les
monobactames sont des beta-lactames monocycliques, initialement découvertes
dans des surnageants de culture de bactéries plutôt que de levures comme dans
le cas des autres beta-lactames. Le regroupement sulfonyle des monobactames
possède une orientation dans l'espace équivalente à
|
|
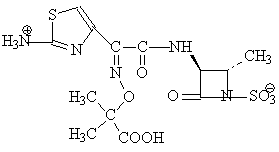
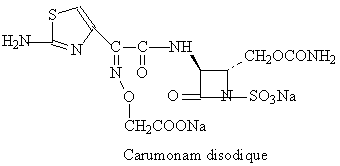
Les
monobactames sont inactifs sur les Gram (+) et les anérobes. Par contre, ils
sont très actifs sur les entérobactéries
et Pseudomonas
aeruginosa. L'activité anti-Gram (-) de l'aztreonam est globalement
comparable à
Les monobactames constituent une alternative de choix pour le traitement des infections graves à Gram (-) chez les patients allergiques aux beta-lactames ou ne pouvant recevoir d'aminoglycosides (insuffisants rénaux).
Administration-voie intraveineuse ou intramusculaire.
4.CARBAPENEMES
Structure chimique
Les carbapénèmes dérivent de la thiénamycine. Leur cycle de base diffère de celui des pénicillines par la présence d'une double liaison et l'absence de soufre endocyclique.
|
|
Representants
-Imipenem -s'utilise en association avec cilastatin
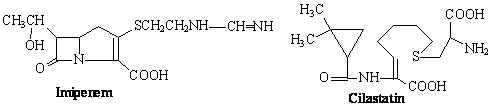
-Meropenem

Spectre d'activité et indications thérapeutiques
Les carbapénèmes (imipenem et meropenem) présentent des CMI très basses vis-à-vis de la majorité des Gram (+), des Gram (-) et des anaérobes, y compris la quasi totalité des souches productrices de beta-lactamases. Ceci leur permet d'agir efficacement dans les infections causées par des germes résistants à tous les autres beta-lactames (sauf les MRSA). Il est donc raisonnable de réserver leur usage pour le traitement d'infections nosocomiales (surtout polymicrobiennes) sévères (infections urinaires, respiratoires, gynécologiques, des articulations et des os).
Pharmacocinetique
- L'absorption de l'imipenem est quasi nulle car il est détruit par l'acidité gastrique et leur administration se fait généralement par voie im ou iv.
- Distribution: comme les autres beta-lactames, l'imipenem diffuse dans les tissus sans s'y accumuler.
- Elimination: - voie rénale. Le médicament est rapidement métabolisé au niveau des cellules tubulaires proximales par un enzyme particulier, la déhydropeptidase I. Cette dégradation présente 2 inconvénients majeurs: tout d'abord, elle inactive l'antibiotique à plus de 60%; ensuite, elle donne naissance à des produits néphrotoxiques. Pour ces raisons, l'imipenem n'est jamais administré seul mais associé à un inhibiteur de la déhydropeptidase, la cilastatine.
Le meropenem possède l'avantage d'être naturellement résistant à la déhydropeptidase rénale I en raison de la présence d'un groupement méthyle en C4 et peut donc être considéré comme stable à ce point de vue dans les conditions d'administration clinique. Les autres propriétés pharmacocinétiques sont celles de l'association imipenem/cilastatine. La pénétration dans le liquide céphalo-rachidien est satisfaisante en l'absence d'inflammation.
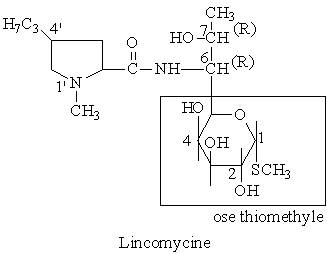
LINCOSAMIDES
Structure chimique
Les lincosamides, représentés à l'heure actuelle par la lincomycine et son dérivé 7-chloro-7-déoxy-, la clindamycine, sont constitués d'un acide hygrique alkylé en position 4' et substitué via une fonction amide par un groupement 6-amino-thio-soctopyrannoside.
Lincomycine-Streptomyces lincolnensis
Clindamycine-semisynthese
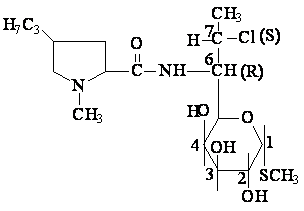
Clindamycine
Les lincosamides couvrent principalement les Gram (+)
et les anaérobies.
La lincomycine peut être est utilisée pour le
traitement des infections à Gram (+) de l'os, de la peau et des tissus mous.
La clindamycine, plus active sur les anaérobies,
est préférée pour traiter les abcès. Il faudra cependant lui associer un
antibiotique actif sur les Gram (-) si l'on redoute la présence de ce type de
germe.
La clindamycine peut aussi être utilisée comme alternative aux ß-lactames chez
les patients allergiques.
L'absorption de
la lincomycine par voie orale se limite à 25-30% de la dose administrée. En outre, elle est
réduite par la prise de nourriture. L'administration intra-musculaire conduit quant à elle à une résorption complète.
La clindamycine administrée par voie orale est, pour sa part, résorbée à 90%.
On l'utilisera donc plus largement pour les traitements ambulatoires. Les
formes d'utilisation courante sont:
- des esters, hydrolysés dans le tube digestif, pour l'administration orale(palitate,
acetate, propionate de Clindamycine);
- le phosphate, rapidement hydrolysé dans le sang pour libérer l'antibiotique
actif, par administration intraveineuse.
Cette dernière voie d'administration est adoptée lorsque l'on souhaite limiter
au maximum une perturbation de la flore intestinale anaérobie.
Les lincosamides peuvent causer une diarrhée en déséquilibrant la flore intestinale par leur activité anti-anaérobie. Ce déséquilibre peut permettre la prolifération de Clostridium difficile dont les toxines A et B entraînent le développement d'une colite pseudo-membraneuse. Cet effet est également rencontré avec d'autres antibiotiques actifs contre les anaérobies (en particulier les beta-lactames à spectre large). La colite pseudo-membraneuse peut être traitée par du métronidazole ou de la vancomycine.
FOSPHONATES
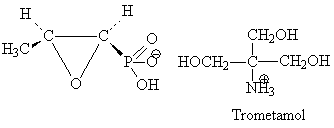
Fosphomicyne acide (-) 1,2-epoxi-propil-phosphonique(1R2S).
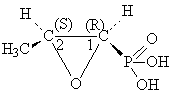
-isolee en cultures de Streptomyces fradiae; en present s'obtient par synthese totale.
Spectre: Staphylococcus sp., Streptococcus pneumoniae, Escherichia coli, Shigella, Salmonella, Klebsiella, Enterobacter, Serratia, Proteus mirabilis et vulgaris, Providencia (inconstant), Pseudomonas (inconstant), Haemophilus, Neisseria meningitidis.
Administration et indications
i.v- sel disodique en infections severe: meningite meningococquee, infections nosocomiales, osteoarticulaire, endocardites, etc;
p.o., sel de calcium ou sel avec le tromethamole, dans le traitement de la cystite aigue chez la femme de moins de 65 ans, dose unique de 3 gramme.
Tous les macrolides doués
d'une activité bactérienne significative présentent une structure chimique
commune constituée d'un macrocycle lactonique (c'est-à-dire qui inclut une fonction
lactone) comprenant un ensemble de 14, 15 ou 16 atomes. Dans tous les
macrolides, à l'exception des kétolides, ce cycle est substitué par un sucre aminé
d'une part et un sucre
neutre d'autre part.
Tous les macrolides utilisés actuellement en clinique, à l'exception de
l'érythromycine, ont été obtenus par modification chimique rationnelle et
dirigée à partir de l'érythromycine ou d'autres produits naturels de la classe
des macrolides.
|
Classification des macrolides suivant la taille du macrocycle |
||||
|
14 atomes |
15 atomes |
16 atomes |
||
|
Dérivés naturels |
Dérivés semi-synthétiques |
Azalides |
Dérivés naturels |
Dérivés semi-synthétiques |
|
Erythromycine Oléandomycine |
Roxithromycine |
Azithromycine |
Josamycine |
|
- Chef de file =
érythromycine
- Sucre aminé attaché en position 5 du macrocyle, appelé désosamine
- Sucre neutre attaché en position 3, appelé cladinose (sauf pour les
kétolides)
- L'érythromycine possède une fonction cétone en position 9 du macrocycle, qui
lui confère une instabilité en milieu acide. Les autres molécules de la
famille, à l'exception de la clarithromycine, ne possèdent plus cette fonction.
|
Macrolides comprenant 14 et 15 atomes dans le cycle |
|
|
Macrolides à 16 atomes dans le cycle macrolactonique- Chef de file =
spiramycine
|
Spectre d'activité
D'une façon générale, tous
les macrolides ont un spectre d'action orienté principalement vers les Gram
(+). En effet, ils pénètrent mal au travers de la membrane externe des Gram (-)
à quelques exceptions notables mais d'un grand intérêt médical (Neisseria spp,
Haemophilus
influenzae, Helicobacter
pylori, Campylobacter,
Legionella
pneumophila, Chlamydia
spp).
Les macrolides sont aussi actifs vis-à-vis de Mycoplasma spp et de divers
germes atypiques (Rickettsia,
Borrelia,
Mycobactéries).
De façon générale, les macrolides présentent un excellent profil de sûreté. Ils ne présentent pas d'effets secondaires susceptibles de mettre en danger la vie du patient.
- Effet secondaire le plus
fréquent lors de l'utilisation de macrolides
- Symptômes: nausées, vomissements, diarrhée, incomfort abdominal
- Liée à un effet gastrocinétique (dose-dépendant); l'érythromycine et les
macrolides à 14 atomes dans le cycle présentent une activité agoniste aux
récepteurs de la motiline, et sont donc capables d'accélérer la vidange
gastrique.
- Incidence la plus élevée avec l'érythromycine (environ 30% d'intolérance
digestive, et 5% d'arrêt du traitement)
- Incidence plus faible avec les nouveaux composés, en partie due à la
meilleure disponibilité, permettant l'administration de doses plus faibles
(effets secondaires gastro-intestinaux chez 3-10% des patients, et arrêt du
traitement dans 1-4% des cas)
|
Usage clinique raisonné des macrolides |
|||
|
Place des macrolides |
Indication |
Germe(s) en cause |
Molécule(s) de choix |
|
Premier choix |
* Infections genitals |
- Neisseria gonorrheae |
azithromycine |
|
* Pneumopathies atypiques |
- Legionella pneumophila |
clarithromycine |
|
|
* Infections à MAC chez |
Mycobacterium avium complex |
azithromycine, |
|
|
* Ulcère gastrique |
Helicobacter pylori |
clarithromycine |
|
|
* Infections respiratoires |
C. diphteriae |
érythromycine |
|
|
Alternative |
* Infections de la peau et des tissus mous |
- Propionibacterium
acnes |
clarithromycine (attention aux résistances!) |
|
* Infections respiratoires et ORL |
|||
|
- Pharyngite |
S. pyogenes, Mycoplasma pneumoniae |
(beta-lactame) |
|
|
- Otite |
S. pneumoniae, M. catarrhalis, H. influenzae |
(beta-lactame ou macrolide) |
|
|
- Sinusite |
S. pneumoniae, M. catarrhalis, H. influenzae |
(beta-lactame ou macrolide) |
|
|
- Bronchite |
S. pneumoniae, M. catarrhalis, H. influenzae |
(beta-lactame ou macrolide) |
|
|
- Pneumonie communautaire |
S. pneumoniae, (H. influenzae, S. aureus), Chlamydia. pneumoniae (enfants |
beta-lactame + macrolide si germes atypiques |
|
1. Interactions medicamenteuses1.1. Interférences médicamenteuses dépendantes d'une interaction avec le cytochrome P450L'érythromycine se lie fortement au cytochrome P450 (type 3A4), ce qui est à la base de ses interactions avec les autres médicaments normalement métabolisés par ce cytochrome. Cette liaison rend l'enzyme indisponible pour la métabolisation d'autres médicaments, dont l'élimination sera donc diminuée, d'où le risqué de toxicité.
1.2. Interférences médicamenteuses indépendantes d'une interaction avec le cytochrome P450A. La liaison des macrolides aux protéines plasmatiques peut déplacer d'autres médicaments (par exemple les anticoagulants oraux) B. Les macrolides augmentent la biodisponibilité orale de la digoxine, ce qui peut entraîner un dosage chez environ 10% des patients. Cette interaction concerne tous les macrolides. |
|||||||||||||||
Avantages et inconvénients des différents macrolides
|
Macrolide |
Avantages |
Inconvénients |
|
Erythromycine |
- Longue expérience
clinique |
- Mauvaise biodisponibilité
(très variable) |
|
Roxithromycine |
- Meilleure
biodisponibilité par rapport à l'érythromycine | |
|
Clarithromycine |
- Bonne biodisponibilité |
- Schéma d'administration
(2x/jour) devrait être revu à la hausse |
|
Azithromycine |
- Gain d'activité sur Haemophilus
influenzae, Moraxella catarrhalis, Chlamydia |
- Faibles concentrations extracellulaires, et donc pas approprié chez des patients pour lesquels un caractère invasif de l'infection peut être craint (par exemple pneumonie à pneumocoques sévère) |
|
Dirithromycine |
- Administration
uniquotidienne |
- Plus faible activité
antibactérienne générale |
|
Miocamycine |
- Meilleure activité sur Mycoplasma
homini |
- Courte demi-vie |
|
Nouvelle classe: les kétolides Les voies actuelles de recherche visent à améliorer l'activité antibiotique des macrolides en produisant des molécules insensibles aux mécanismes de résistance d'intérêt clinique. Dans cette optique une nouvelle classe de macrolides a été développée, appelée kétolides. Caractéristiques principales des kétolides, et en
particulier de la télithromycine:
|
LES RIFAMYCINES (ANSAMYCYNES, FAUX
MACROLIDES)
Les ansamycines constituent une famille de composés chimiques dont les
représentants peuvent être classés en deux groupes :
- les ansamycines de type naphtalène
- les ansamycines de type benzénique
Les ansamycines de type
naphtalène regroupent des composés montrant une activité antibactérienne ou
antivirale alors que les ansamycines de type benzénique comportent des
molécules à activité antitumorale.
Les rifamycines sont des
composés appartenant aux ansamycines de type naphtalène et ont été solées à
partir de 1957 de la bactérie Nocardia mediterranei.
Parmi les composés isolés, la rifamycine-B s'avéra active envers les
germes Gram (+) ainsi que Mycobacterium tuberculosis ainsi que quelques
germes Gram (-). Aujourd'hui elle ne s'utilise plus.
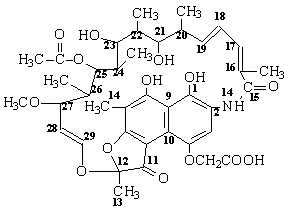
Rifamycine B
La rifampicine qui est un composé semi-synthétique issu de la la rifamycine-B, montra l'activité la plus élevée, ainsi que la plus faible toxicité. Il est aujourd'hui l'un des médicaments de choix des infections à mycobactéries.
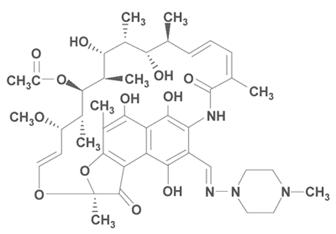
Rifampicine ( N-amino-N'-méthylpipérazine-hydrazone)
Indication majeur-le traitement de la tuberculose (tuberculostatique majeur), en association avec des autres antituberculeux; RIMACTAN- capsules
Interactions medicamenteuses-par induction enzimathique (contraceptive orale!)
De nouveau dérivé (rifabutine) trouvent des indications particulières (la tuberculose chez les patients immunodéprimés).
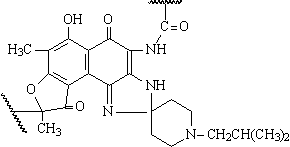
Rifabutine GLICOPEPTIDES
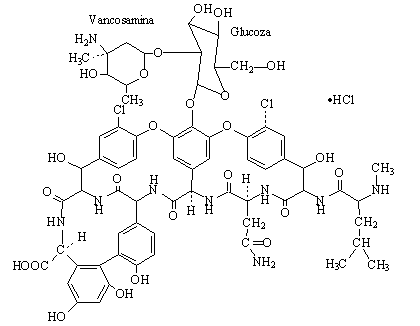 Vancomicine
Vancomicine
Spectre antibacterien limite aux bacteries G(+): staphylococcus dores meti-S ou meti-R, Streptococcus, Enterococcus, Corynebacteries, Clostridium.
Emplois
- i.v.-endocardites staphylococciques, infections streptococciques
-p.o.(nonabsorbable)-colite pseudomembraneuse produite de Clostridium difficile.
VANCOCIN- flac. inj. a 500 mg, 1 g., capsules a 125 mg et 250mg.
Teicoplanine-Actinoplanes teichomyceticus
Structure et activite tres voisines de celles de la vancomycine.
TARGOCID-flac. inj.
POLIPEPTIDES
Bacitracine- complexe d'antibiotiques polypeptidiques produit par Bacillus subtilis et Bacillus licheniformis. La bacitracine commerciale est constituée d'un mélange d'au moins neuf bacitracines ; la bacitracine A étant le constituant principal de cette mixture.
Spectre- bactéries Gram (+) : Actinomyces, Fusobacterium,
Haemophilus influenzae, Neisseria et Treponema pallidum.
La bacitracine est utilisée locale
sous forme de pommade ou de gouttes, dans les infections cutanées ou oculaires,
souvent en association avec une polymyxine et/ou la néomycine.
A l'utilisation systemique, elle est nephrotoxique.
Polymyxines
Les polymyxines A, B, C, D, E,
F, K, M, P, S et T sont des antibiotiques peptidiques cycliques qui ont été
isolées de Bacillus polymyxa, à partir de 1947.
De nos jours, seules la
polymyxine B et la polymyxine E (ou colistine) sont utilisées en thérapeutique.
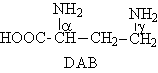
Y - acyde gras
Spectre- bactéries Gram
(-) : Bordetella, Enterobacter, Escherichia coli, Klebsiella, Pasteurella,
Pseudomonas aeruginosa, Salmonella, Shigella , Vibrio).
Etant donné leur faible absorption, les possibles complications d'ordre neurologique et leur néphrotoxicité, ces antibiotiques sont
réservés à des cas extrèmes (lorsque les bactéries sont résistantes à tous les
autres antibiotiques) et à l'usage topique (traitement local des infections de
la peau, des muqueuses, des yeux et des oreilles).
Dans le cas d'une otite, il faut avoir à l'esprit que l'administration de polymyxine sur un tympan perforé peut entrainer une toxicité cochléaire et vestibulaire irréversible.
Utilisations
-infections urinaires a Pseudomonas aeruginosa (polimixines E, voie parenterale sous forme de methanesulfonate)
-infections intestinales a Enterobacteriaceae, orale, compr.
-locale.
STREPTOGRAMINES (SINERGYSTINES)
Produits par certaines espèces de Streptomyces.
Pristinamycines et Virginiamycines
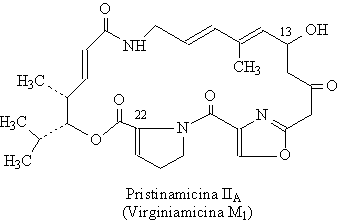
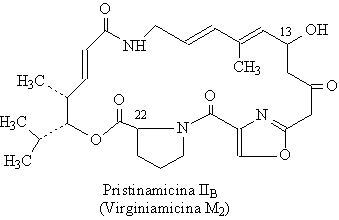
Ces composés sont classifiés en deux grandes groupes :
- le groupe A (ou M) : ce sont des lactones macrocycliques
(macrolactones), de masse moléculaire environ 500. (exemples : pristinamycines
II et virginiamycines M)
- le groupe B (ou S) : ce sont des hexapeptides cycliques, de masse
moléculaire environ 800.
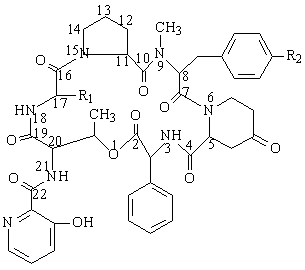
|
R1 |
R2 |
|
|
|
C2H5 |
N(CH3)2 |
|
Pristinamycine IB |
C2H5 |
N(CH3)2 |
|
Pristinamycine IC |
CH3 |
N(CH3)2 |
|
Virginiamycine S1 |
C2H5 |
H |
|
Virginiamycine S |
CH3 |
H |
Les pristinamycines : Ces composés naturels constituent
un mélange de métabolites secondaires produits par Streptomyces
pristinaespiralis. Les constituants majeurs sont la pristinamycine IA (correspondant à 24-38 % du mélange) et la pristinamycine IB (54-68 % du mélange).
Les virginiamycines : Ces composés naturels constituent un mélange de
métabolites secondaires produits par Streptomyces virginiae.
Les pristinamycines et les virginiamycines naturelles sont des composés très
difficilement solubles dans l'eau, ce qui limite fortement leur utilisation en
thérapeutique.
La modification chimiques de ces composés de base a permis l'élaboration de
composés d'hémi-synthèse solubles dans l'eau, tels la quinupristine du
groupe A et la dalfopristine appartenant au groupe B.
Mode d'action des synergistines:
-Une synergistine du groupe A associée à une synergistine du groupe B agissent
de manière synergique, ce qui a donné le nom générique .
- lorsqu'on les associe, on obtient une activité antibiotique plusieurs fois
supérieure à
Spectre
Virginiamycine-Staphylococcus, N. gonorhoeae, H. influenzae Pristinamycine - Staphylococcus, Streptococcues
PYOSTACINE(Virginiamycine) compr. a 500 mg; 2-4 g/jour; la copii 50-100mg/kg/jour.
STAPHYLOMICINE(Pristinamycine) compr., susp. orale.
SYNERCID(dalfopristine+quinupristine) - poudre d'usage iv .
AMINOGLYCOSIDES
Structure chimique
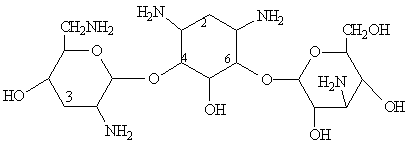
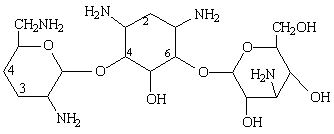
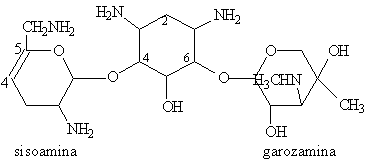
Les premiers aminoglycosides découverts ont été des molécules naturelles produites par des souches de Streptomyces (streptomycine, néomycine, kanamycine, tobramycine) ou d'Actinomyces (gentamicine, sisomicine) .
A partir de ces dérivés naturels, des produits semi-synthétiques (amikacine, isépamicine, nétilmicine) ont été conçus dans le but d'obtenir des molécules insensibles à l'inactivation par les bactéries devenues résistantes aux aminoglycosides naturels. Ces composés se sont aussi avérés moins toxiques que les composés parents.
Les aminoglycosides sont des molécules polaires et polycationiques.
Leur structure de base commune comporte un aminocyclitol (cycle à 6 chaînons avec des groupements amines), auquel se lient par des ponts glycosidiques 2 (ou exceptionnellement 3) hexoses. Ces cycles peuvent porter des substituants dont les plus critiques sont les groupes hydroxyles et les groupes basiques.
Les
aminoglycosides peuvent être classés
d'une part en fonction de la nature de leur aminocyclitol, et d'autre part des
sucres qui le substituent:
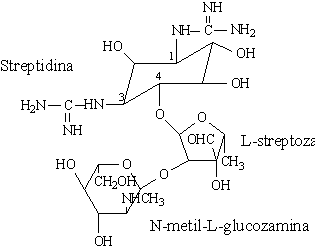
- L'aminocyclitol est soit la streptidine (dans la streptomycine) ou la
2-désoxystreptamine (dans tous les autres aminoglycosides).
- Les sucres sont liés à l'aminocyclitol en position 4 et 6 pour
l'ensemble des aminoglycosides, à l'exception des la néomycine et de la
paramomycine pour lesquelles les sucres sont liés en position 4 et 5.
 Les structures des aglicons
Les structures des aglicons
Les structures complete des aminoglicosydes
Streptomycine
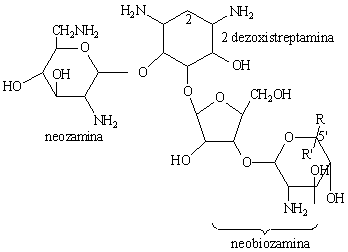
|
R |
R' |
Neomicyne |
|
H |
CH2NH2 |
B |
|
CH2NH2 |
H |
C |
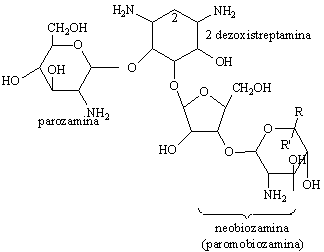
|
R |
R' |
Paromomicyne |
|
H |
CH2NH2 |
I |
|
CH2NH2 |
H |
II |
Kanamycines
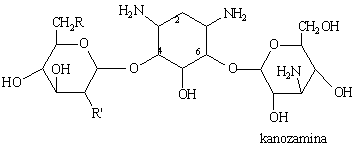
|
Kanamycine |
R |
R' |
|
A |
NH2 |
OH |
|
B |
NH2 |
NH2 |
|
C |
OH |
NH2 |
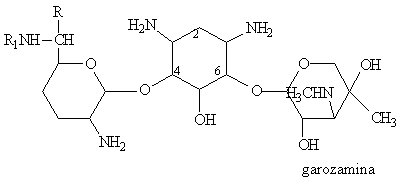
|
Gentamycine |
R |
R1 |
Ose (4) |
|
C1 |
CH3 |
CH3 |
Purpurosamine A |
|
C2 |
CH3 |
H |
Purpurosamine B |
|
C1A |
H |
H |
Purpurosamine C |
-plus resistantes aux enzimes bacteriennes qui inactivent la kanamycine
Tobramycine (3-desoxi-kanamycine B
Dibekacine (3,4 didesoxi kanamycine B
Dibekacine
Butirosines- amides de la kanamycine avec l'acide a-hidroxi-g-aminobutirique
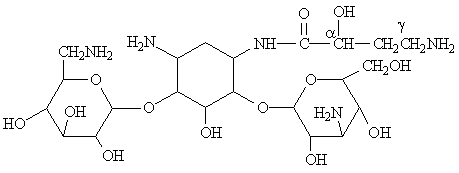
Amikacine
-plus resistantes aux enzimes bacteriennes qui inactivent la gentamycine
Sisomicine
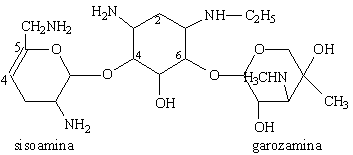
Netilmicine
Butirosine
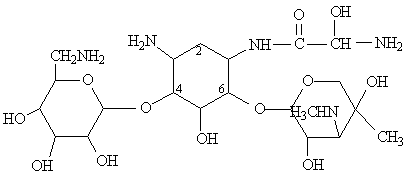
Isepamicine
- surtout actifs sur les Gram (-),
y compris les entérobactéries et Pseudomonas aeruginosa.
- présentent aussi une activité vis-à-vis des Gram (+), principalement Staphylococcus.
La coadministration d'une ß-lactame assure une activité synergique, en
améliorant la pénétration de l'aminoglycoside à travers la paroi bactérienne.
- inefficaces vis-à-vis des bactéries anaérobies, dans lesquelles ils ne
pénètrent pas.
- activité in vitro vis-à-vis des mycobactéries (la streptomycine a été un des
premiers antibiotiques antituberculeux).
- le choix d'un aminoglycoside spécifique doit se fonder sur le profil des résistances rencontrées dans le milieu considéré d'une part, et sur des considérations d'ordre toxicologique d'autre part.
Les aminoglycosides sont utilisés principalement dans le traitement des infections sévères à Gram (-) en milieu hospitalier, y compris chez les patients neutropéniques. Celles-ci peuvent inclure Pseudomonas.
Utilisation en association avec d'autres antibiotiques
|
Exemples d'association d'aminoglycoside avec un autre antibiotique |
|
|
Indication clinique |
Association |
|
Endocardite à entérocoque ou staphylocoque |
Aminoglycoside + beta-lactame, vancomycine |
|
Suspicion d'infection à P. aeruginosa |
Aminoglycoside + pénicilline antipseudomonale |
|
Infections intra-abdominales |
Aminoglycoside + métronidazole ou clindamycine |
La streptomycine et l'amikacine peuvent également constituer l'un des médicaments de la poly-antibiothérapie de la tuberculose (en association avec l'isoniazide, la rifampicine et l'éthambutol). En pratique, actuellement, ils ne sont que rarement utilisés dans cette indication.
La toxicité rénale induite par les aminoglycosides est le plus souvent réversible en cas d'arrêt de traitement.
- au niveau vestibulaire : nausées, vertiges, nystagmus; se
rencontre surtout avec la streptomycine.
-au niveau cochléaire: bourdonnements d'oreille et
pertes auditives commençant d'abord par les hautes fréquences (effet dont le
patient ne se rend souvent pas compte) et évoluant ensuite vers les fréquences
conventionnelles, entrainant une surdité qui peut être complète.
Contrairement à la toxicité rénale, la toxicité auditive est irréversible (car elle touche un tissu nerveux) et dès lors cumulative si l'on administre plusieurs traitements au même patient.
RESUME
-Les aminoglycosides sont des molécules polaires et polycationiques, dont la
structure de base comporte un aminocyclitol
auquel sont attachés des sucres. -Les
aminoglycosides agissent au niveau du ribosome bactérien et perturbent la
synthèse protéique. Ils sont rapidement bactéricides, exercent un effet post-antibiotique ainsi qu'un effet de première exposition. Ces propriétés
justifient l'usage de doses uniquotidiennes.
-Il existe 3 mécanismes de résistance aux aminoglycosides, dont le principal
est la production d'enzymes inactivant l'antibiotique.
-Les aminoglycosides sont surtout actifs sur les Gram (-) y compris Pseudomonas,
et sont indiqués dans le traitement des infections sévères à Gram (-) en milieu
hospitalier. Ils sont souvent utilisés en combinaison avec d'autres
antibiotiques comme les beta-lactames (effet synergique), la vancomycine, ou
encore les antibiotiques actifs contre les bactéries anaérobies.
-Les aminoglycosides sont administrés par voie intramuscualire ou intraveineuse. Ils sont éliminés par voie rénale. L'administration uniquotidienne permet d'obtenir une efficacité maximale ainsi qu'une toxicité minimale.
-Les effets secondaires des aminoglycosides sont la néphrotoxicité, l'ototoxicitié.
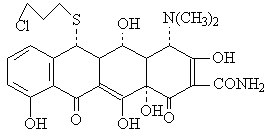
TETRACYCLINES
Antibiothiques bacteriostatiques, produits par souches de Streptomyces, ayant une large spectre d'activite.
Structure chimique-noyau naphtacene hidrogene et substitue
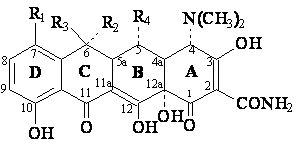
|
DCI |
R1 |
R2 |
R3 |
R4 |
t1/2 (ore) |
Clortetacycline |
Cl |
CH3 |
OH |
H | |
|
Tetracycline |
H |
CH3 |
OH |
H | |
|
Oxitetracycline |
H |
CH3 |
OH |
OH | |
|
Demetil clortetracycline |
Cl |
H |
OH |
H | |
Demetiltetracycline |
H |
H |
OH |
H | |
|
Doxicycline |
H |
CH3 |
H |
OH | |
|
Metacycline |
H |
=CH2 |
OH | ||
|
Minocycline |
N(CH3)2 |
H |
H |
H | |
|
Aminocycline |
NH2 (9) |
H |
H |
H |
Clasification (critere mode d'obtention)
tetracyclines de biosynthese
Clortetracycline (aureomicine)-Streptomyces aureofaciens
Tetracycline-Streptomyces viridifaciens
Oxitetracycline-Streptomyces rimosus
Demetilclortetracycline (Demeclocycline)-Streptomyces aureofaciens (mutant)
Demetiltetracycline; Streptomyces aureofaciens
tetracyclines de semisynthese
Doxicycline (Vibramycine)
Metacycline (Rondomycine)
Minocycline
Aminocycline
Proprietes phisico-chimique
-caracter amphotere
- proprietes complexantes pour les ions Fe+3, Cu+2, Fe+2, Co+2, Zn+2 Ca+2 et Al+3.
-en milieu basique ( pH>8.5) les tetracyclines sont instable :

-en milieu acide, les tetracyclines sont aussi instable et se transforme en epitetracyclines et anhydrotetracyclines
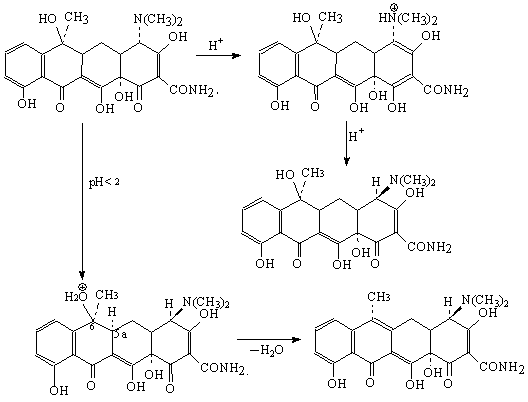
Tetracyclines de semisynthese
Obtention

Metacycline

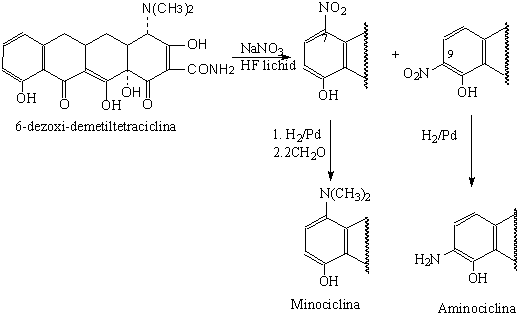

Indications: infections a germes sensibles et en particulier respiratoires, pneumonias atypiques (infections a Chlamidia pneumoniae, Mycoplasma pneumoniae), genito-urinaires, sysemiques et acne vulgaire. Par suite de leur bonne penetration intracellulaire (Doxicycline, Minocycline), ils constituent des traitements de choix des brucellosis et des ricketsioses.
Effets secondaires
-risque de coloration jaune des dents et hypoplasie de l'email dentaire en cas d'utilisation chez l'enfant de moins de 8 ans.
-photosensibilisation cutanee en cas d'exposition au soleil
Perspectives dans la recherche des tetracyclines
- Inhibiteurs des proteines Tet
PHENICOLES
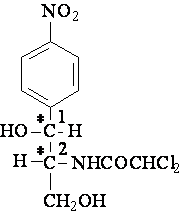
Les phénicolés sont des antibiotiques potentiellement utiles en raison de leur
large spectre et de leur bonne pénétration dans le système nerveux central,
mais dont l'usage est actuellement limité par leur toxicité médullaire.
Les phénicolés sont des dérivés de l'acide dichloroacétique, porteurs aussi
d'un phényle substitué. Le groupement dichloroacétamide est certainement
important pour l'activité antibiotique.
Deux molécules seulement sont utilisées en clinique : le chloramphénicol, et le
thiamphénicol.
Chloramphenicol
Denomination chimique:D(-) treo-1-p-nitrofenil-2-dicloracetamido-1,3-propan-diol
Convention du Fischer:
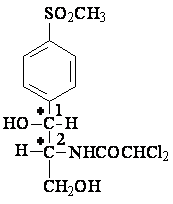
Thiamphénicol
Mechanisme d'action
Comme les macrolides et les lincosamides, les phénicolés se fixent à la
sous-unité 50 S des ribosomes bactériens. Ils inhibent la synthèse des
protéines en empêchant la liaison du complexe amino-acyl-ARNt à son site de
fixation, et donc la réaction de transpeptidation.

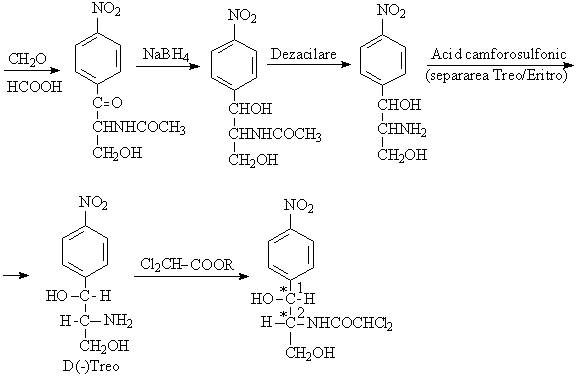
Absorbtion orale
-- esters avec les acydes gras

|
R |
DCI |
|
|
Palmitate de chloramphenicol |
|
|
Stearate de cloramfenicol |
|
|
Palmitoil-glicolat de cloramfenicol (n=14) Stearoil-glicolat de cloramfenicol (n=16) |
Solubilite dans l'eau
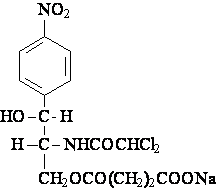
esters avec les acydes dicarboxyliques
Hemisuccinate de Chloramphenicol et sodiu
perfusions IV
Spectre( large)
-Gram (+): stafilococcues, streptococcues; Bacillus antracis, Clostridii
-Gram. (-): meningococque; Bacteroides fragilis, Salmonelle, Shigella, Brucella, E. Coli, Haemophilus influenzae, Bordetella.
-Spirochetes, ricketsii, chlamidii.
- fievre tiphoide et paratiphoide, pneumonia a pneumococcues ou Chlamydia, brucellose, meningite meningococice et a Haemophilus, disenteria bacillaire, infections urinaire.
-locale - conjunctivites, keratites, otites, inf. vaginales(ovules), dermatologie
- disbacterioses , candidose et avitaminose B ;
-au niveau sanguin- toxicite medullaire
-sindrome Gray au nouveau-ne
Presentation pharmaceutique
-p.o.: compr., capsules a 125 et 250 mg,
-parenteral (hemisuccinate de chloramphenicol et sodiu):
-local: oculoguttae, otoguttae, poudres, ovules, cremes;
OXAZOLIDINONES
Linezolid
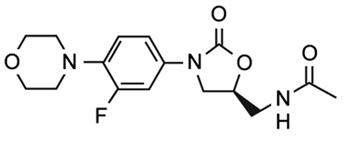
Linezolid
Le linezolid est actuellement la seule
molécule utilisée en clinique.
Les germes sensibles sont : Staphylococcus
aureus, les staphylocoques coagulase négative, le pneumocoque, les
entérocoques, les streptocoques b-hémolytiques du groupe A, Bacillus cereus,
Bacteroides fragilis, clostridium difficile, mais aussi Pasteurella
multocida, les Legionelles, les Fusobacterium, Haemophilus
influenzae, Moraxella catarrhalis...
Les composés de type oxazolidinones agissent en inhibant la synthèse protéique
Utilisation-voie orale, compr. ZYVOX
Antibiothiques-sujets pour l'examen
Generalites et betalactames
Cibles bacterienne des antibiothiques (schema)
Mecanismes de resistance aux antibiothiques(tableau)
Betalactames-pricipaux cicles
Penicyllines -structure generale, representants, classification
Penicyllines retard
Obtention des penicyllines de semisynthese
Isoxazolylpenicillines-structure generale, representants, indications
Aminobenzilpenycillines-representats, utilisation
Carboxipenicyllines-representants, utilisation
Penicyllines-spectre d'activite (comparatif)
Inhibiteurs des betalactamases-representants, indications des associations avec les penicyllines
Cephemes-structure des principales sous-groupes
Cephalosporines de semisynthese de Iere gen.-3 representants, spectre et indications
Cephalosporines de semisynthese de IIeme gen.-3 representants, spectre et indications
Cephalosporines de semisynthese de IIIeme gen.-3 representants, spectre et indications
Cephalosporines-relations-structure-activite-proprietes pharmacocinetiques
Monobactames-representants, spectre et indications
Carbapenems- representants, spectre et indications
Lincosamides
Lincomycine et Clindamycine-spectre d'activite, indications, effets secondaires
Fosphonates
Fosphomycine-structure chimique, administration, indications
Macrolides
Classification des macrolides suivant la taille du macrocycle
Conception des macrolides comprenant 14 et 15 atomes dans le cycle(schema)
Erythromycine-Optimisation des proprietes pharmacocinetiques et biopharmaceutiques
Macrolides-indications de premier chiox
Erithromycine et Azithromycine-avantages et inconvenients
Ketolides-caracteristiques principales
Rifamicines
Rifampicine et rifabutine-spectre, indications
Glicopeptides
Vancomycine-spectre, emplois
Aminoglycosides
Aminoglycosides-classification suivant la nature de leur aminocyclitol, representants de chaque classe
Les structures des aminocyclitols
Analogues de la kanamycine et gentamycine-avantages, representants
Aminoglycosides-spectre et indications
Aminoglycosides-effets secondaires
Tetracyclines
Tetracyclines-structure generale, classification
Tetracyclines-indications, effets secondaires
Phenicoles
Chloramphenicole-structure chimique, denomination chimique
Chloramphenicole-optimisation des proprietes pharmacocinetiques et biopharmaceutiques
Chloramphenicole-spectre, indication, reactions indesirable
|