В.В.Безуглов*, обров А.В.Арчаков
Институт биоорганической химии им. М.М.Шемякина и Ю.А.Овчинникова РАН, 117871 Москва, ул. Миклухо-Маклая, 16/10; факс (095)335-7103, электронная почта: [email protected]
Амиды жирных кислот предст 24524v218y авляют собой группу липидных биорегуляторов, образующихся из длинноцепочечных насыщенных и ненасыщенных жирных кислот путем амидирования соответствующими аминами. Наиболее изучены этаноламиды жирных кислот, для которых установлен альтернативный путь биосинтеза - через гидролиз N- D CB1) CB2) и рассматриваются как эндогенные лиганды этих рецепторов. Новую группу биорегуляторов предст 24524v218y авляют амиды жирных кислот с биологически активными аминами (ванилинамином, дофамином, серотонином).
: анандамид, олеамид, эрукамид, этаноламиды жирных кислот, амидгидролазы, каннабиноидные рецепторы, N-ацилфосфатидилэтаноламин, серотонин, дофамин.
], N-ацилированных липидов [ N-
N- N- Биоэффекторные свойства этих и родст 24524v218y венных соединений, а также их биосинтез и метаболизм рассмотрены в данном обзоре.
каннабиноиды. Каннабиноиды являются лигандами для специфического мембранного рецептора головного мозга (центральный каннабиноидный рецептор или СВ1), с Gi-белком [ ], и сохраняет способность связывать субстрат и взаимодействовать с G-белком при растворении мембраны [ CB1 ] и широко предст 24524v218y авлен в структурах головного мозга, особенно в гипоталамусе, коре, базальных ядрах, мозжечке, а также в структурах, связанных с обонянием [ CB
Обнаружен также периферический каннабиноидный рецептор (CB2) [ CB1 CB2, CB1, сопряжен с аденилатциклазой посредст 24524v218y вом Gi-белка [ NK- Места связывания каннабиноидов были обнаружены на B-лимфоцитах селезенки, лимфоузлов, Пейеровых бляшек [
Сопоставляя этот факт с тем, что каннабиноиды оказывают определенный психотропный эффект, можно предположить, что CB1 участвует в регуляции процесс CB2
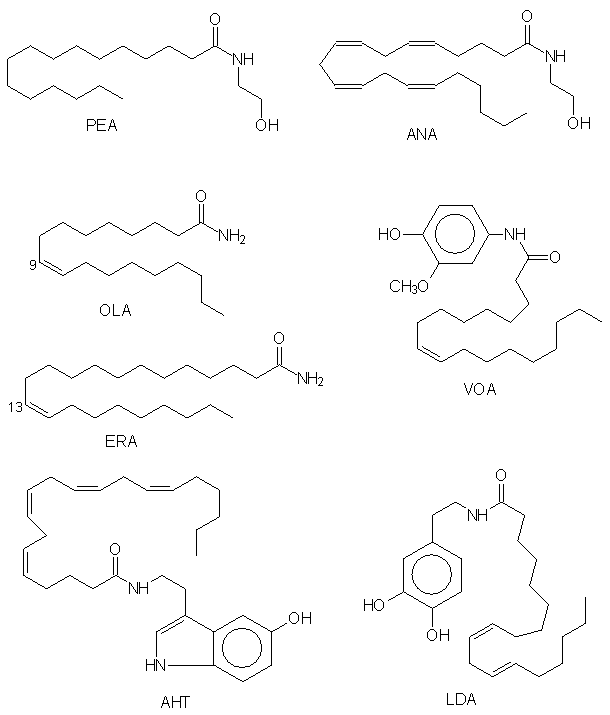
Наличие каннабиноидных рецепторов свидетельствует о том, что в организме присутствует агент, сходный по физиологическому действию с экзогенными каннабиноидами. Такой агент был выделен из мозга свиньи [ ] и идентифицирован как этаноламид арахидоновой кислоты, названный авторами анандамидом (от санскритского «ананда» - блаженство) (рис.1). Анандамид
Впоследст 24524v218y вии из мозга свиньи были выделены два новых этаноламида жирных кислот: дигомо-g CB1 w
Известно, что каннабиноиды при взаимодействии с клетками и тканями, экспрессирующими CB, ингибируют стимулированную (форсколином или секретином) активность аденилатциклазы, а также ингибируют открывание кальциевых каналов N-типа [ a b g-субъединиц G-белка. На различных клеточных моделях было показано, что этаноламиды полиненасыщенных ЖК также ингибируют стимулированную активность аденилатциклазы [ ], открывание кальциевых каналов N-типа [32, tT ]. CB RCONHCH2CH2OH)
|
RCO |
Ki, M | |||
|
CB1 |
||||
|
w |
A |
HU-243 | ||
|
B |
CP-55,940 |
] |
||
|
w |
C |
HU-243 |
] |
|
|
w |
>2000 |
D |
CP-55,940 |
] |
|
w |
D |
CP-55,940 |
] |
|
|
w |
B |
CP-55,940 |
] |
|
|
w |
D |
CP-55,940 |
] |
|
|
w |
D |
CP-55,940 |
] |
|
|
w |
A |
CP-55,940 |
] |
|
|
w |
>10000 |
D |
CP-55,940 |
] |
|
w |
>1000 |
A |
HU-243 |
] |
|
w |
A |
HU-243 |
] |
|
|
w |
>10000 |
A |
HU-243 |
] |
|
w |
A |
HU-243 |
] |
|
|
w |
B |
CP-55,940 |
] |
|
|
w |
B |
CP-55,940 |
] |
|
|
w |
B |
CP-55,940 |
] |
|
|
w |
D |
CP-55,940 |
] |
|
|
w |
A |
HU-243 |
] |
|
|
w |
A |
HU-243 |
] |
|
|
w |
B |
CP-55,940 |
] |
|
|
w |
B |
CP-55,940 |
] |
|
|
w |
>25000 |
A |
HU-243 |
] |
|
w |
A |
HU-243 |
] |
|
|
w |
>41400±6000 |
B |
CP-55,940 |
] |
|
w |
A |
HU-243 |
] |
|
|
w |
>1000 |
A |
HU-243 |
] |
|
B |
CP-55,940 |
] |
||
|
A |
HU-243 |
] |
||
|
>100000 |
A |
CP-55,940 |
] |
|
|
CB2 |
||||
|
w |
E |
WIN-55,212-2 |
] |
|
|
w |
F |
CP-55,940 |
] |
|
|
w |
F |
CP-55,940 |
] |
|
|
w |
C |
HU-243 |
] |
|
|
w |
G |
WIN-55,212-2 |
] |
|
|
w |
F |
CP-55,940 |
] |
|
|
w |
F |
CP-55,940 |
] |
|
|
w |
F |
CP-55,940 |
] |
|
|
w |
F |
CP-55,940 |
] |
|
|
G |
WIN-55,212-2 |
] |
||
A - B - Ltk- (L) CB1 C CHO-K1- CB1 CB2 человека, D - P2- E COS- CB2 человека, F - мембраны мышиных AtT-20 CB2 , G RBL-2H3
PMSF. CB под действием иcпытуемых соединений, а не к прямому связыванию анадамида и родст 24524v218y венных соединений с рецептором.
Периферический каннабиноидный рецептор CB2, хорошо связывающий как природные каннабиноиды (например, THC), так и синтетические каннабимиметики (WIN-55,212-2 и CP-55,940), демонстрировал низкое сродст 24524v218y во к ANA , который вытеснял радиолиганды с CB2 в 30 раз хуже, чем с CB1 (см. таблицу). Было показано, что синтетические каннабиноиды значительно ингибировали стимулированное мышиными моноклональными антителами IgE против динитрофенола выделение [3H]серотонина клетками базофильной лейкемии крыс (RBL-2H3), которые экспрессировали CB2 [ ]. ANA, который вытеснял с мембраны [3H]WIN-55,212-2, оказался не способен блокировать выделение серотонина. При добавлении ANA (но не арахидоновой кислоты и этаноламина) совместно с WIN-55,212-2 и другими активными каннабиноидами нелипидной природы, действие последних ослаблялось. Отсюда следовало, что ANA является не агонистом, а антагонистом CB2. N-Пальмитоилэтаноламин, в отличие от ANA оказался высокоактивным как в вытеснении [3H]WIN55212-2 с мембраны, так и в ингибировании IgE-стимулированного выделения серотонина. ANA ослаблял эффект PEA и каннабиноидов. Эти результаты позволили авторам предположить, что эндогенным лигандом CB2 является PEA, а возможно, также этаноламиды и других насыщенных ЖК ] PEA проявлял низкое сродст 24524v218y во к CB COS-7 ] CB2
CB2 , который проявлял также сродст 24524v218y во к CB1 [40] и обладал характерными каннабимиметическими фармакологическими характеристиками [ CB-
Физиологические эффекты ANA и родст 24524v218y венных соединений на организм оказались аналогичны эффектам каннабиноидов, хотя имели меньшую продолжительность действия, что, по-видимому, связано с их гидролизом под действием амидгидролаз. Внутрибрюшинное введение ANA мышам и крысам приводит к каталепсии, понижению температуры, анальгезии, потере подвижности [ ]. Как THC, так и ANA усиливают действие мусцимола (агониста GABA-рецептора), индуцирующего каталепсию у крыс [ ]. Более детальное исследование физиологического ответа мышей на введение ANA различными способами показало, что при введении ANA внутривенно, внутрибрюшинно и в спинной мозг наблюдаются потеря чувствительности (>80% максимально возможной при внутривенном и спинномозговом введении), значительное понижение температуры (на 2 - 4 град.), уменьшение подвижности и каталепсия. Максимальный эффект на двигательную активность (ослабление на 85%) при внутривенном и внутрибрюшинном введении ANA наблюдался немедленно, а при спинномозговом введении - через 10 мин. По сравнению с THC ANA оказывал более слабое действие (от 1,3 до 18 раз) во всех поведенческих тестах. Введение ANA в спинной мозг приводило к потере чувствительности независимо от норбиналторфимина, который блокирует этот эффект у THC [
ANA и синтетические каннабимиметики оказывают ингибирующее действие на работу ионных каналов, связанных с серотониновым 5-НТ3-рецептором. Причем этот эффект не связан с изменением уровня cAMP [ ]. ANA также проявлял способность понижать содержание дофамина в стриатуме крысы, а также снижать активность тирозингидроксилазы и изменять соотношение дофаминовых D1- D2-рецепторов после внутрибрюшинного ыло также показано ингибиторное влияние ANA на выделение пролактина
ионофорами, деполяризующими агентами, глутаматом) происходят синтез N- G-белком [ функционирование нейронов может регулироваться с помощью N-
ANA приводит к возникновению брадикардии, а также вызывает вначале быстрое повышение, а затем длительное снижение кровяного давления Было показано, что прессорный эффект вызван, по-видимому, прямым действием ANA , а гипотензивный эффект опосредован ингибиторным влиянием ANA на выделение нервными окончаниями норадреналина в сердце и сосудах, поскольку этот эффект блокировася специфическим антагонистом СВ1 SR141716А [ ANA
Отмечено также влияние ANA на процессы размножения. Была показана способность ANA снижать фертильность сперматозоидов морского ежа за счет торможения акросомальной реакции, которая происходит при взаимодействии сперматозоида с оболочкой яйцеклетки APE . Были показаны наличие ANA и его предшественника в семенниках крысы, а также биосинтез указанных соединений в этой ткани
PEA , ]. В конце 60-х годов было показано, что PEA повышает неспецифическую устойчивость к различным бактериальным токсинам и травматическому шоку [ PEA
В работах американских исследователей было показано, что этаноламиды насыщенных и моноеновых ЖК влияют на деятельность кальциевых каналов, блокируя выход кальция из клеток и органелл в условиях гипоксии [
При изучении синтеза фосфатидилэтаноламина с помощью [14C N- ]. Синтез протекал с насыщенными и ненасыщенными ЖК с длиной цепи от 12 до 24 углеродных атомов. Амидные производные не образовывались, когда в качестве аминов использовали холин и различные аминокислоты, однако наблюдалось N-ацилирование фениламина, N-оксифениламина и 1-амино-2-пропанола ] N-ацилэтаноламинов обнаруживается в гомогенатах печени, мозга и почек с преобладанием в микросомальной фракции, хотя и в присутствии митохондрий синтез протекает достаточно активно. Из насыщенных жирных кислот лучшими субстратами оказались миристиновая, пальмитиновая и стеариновая, из ненасыщенных - олеиновая и линолевая [
Синтез этаноламидов полиненасыщенных ЖК также наблюдается при инкубации с гомогенатами различных тканей млекопитающих [ ]. Синтез ANA лучше всего протекал с микросомами мозга и менее активно - с микросомами почек, печени и легких. Среди цитозольных фракций исследованных тканей существенная синтетическая активность была обнаружена только в цитозоле мозга. Арахидоновая кислота оказалась лучшим субстратом как для мембранных, так и для цитозольных препаратов мозга среди всех исследованных кислот. Селективность ферментативной системы по отношению к ней оказалась более чем 50-кратной при сравнении с пальмитиновой. Синтез является ATP- и CoA-независимым, что было ранее отмечено также для синтеза PEA ]. Эти данные были подтверждены на примере синтеза этаноламидов различных ЖК на мембранах мозга быка. По кинетическим параметрам субстраты можно расположить в следующем ряду в порядке убывания: арахидоновая > g-линоленовая, 11,14-эйкозадиеновая > пальмитиновая > адреновая, докозагексаеновая кислота. Наибольшая синтетическая активность была обнаружена в гипоталамусе, меньшая - в таламусе, полосатом теле, коре и наименьшая - в мозжечке и продолговатом мозге [ ANA PLA2 и PLD.
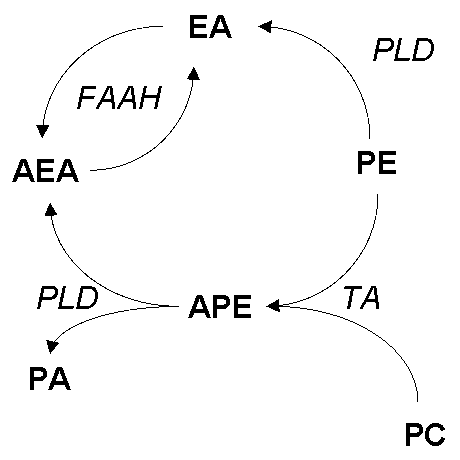
Альтернативный путь синтеза этаноламидов ЖК гидролизом соответствующих N-ацилфосфатидилэтаноламинов был открыт при исследовании инфарктного сердца собаки. Накопление в пораженных участках миокарда как N-ацилэтаноламинов, так и его предшественника - APE APE ]. Он оказался активен в широком диапазоне pH - от 4,5 до 8,5 и не требовал Ca2+ или других двухвалентных катионов, но ингибировался Zn2+. Соли желчных кислот и другие ионные детергенты ингибировали действие фермента, а тритон X-100 активировал реакцию. Фермент расщеплял диацильную и плазмалогенную формы APE и лизо-APE, но не действовал на фосфатидилхолин и фосфатидилэтаноламин. Таким образом было показано, что по субстратной специфичности, как и по отношению к ингибиторам и активаторам, обнаруженная фосфолипаза отличается от PLD, ранее найденной в мозге и других тканях млекопитающих [ ] ферментативного механизма, приводящего к образованию этаноламидов ЖК из экзогенного APE.
В работах 70-х годов не было отмечено образования этаноламидов полиненасыщенных жирных кислот, а APE, обнаруженные в тканях млекопитающих, несли в N-положении главным образом насыщенные кислоты, тогда как этаноламиды полиненасыщенных ЖК с числом атомов более 18 не были зарегистрированы [84, ]. Синтез ANA из соответствующего APE впервые был описан в первичной культуре нейронов мозга крысы в 1994 г. [ ]. Ингибиторы PLA2 (диметилэйкозадиеновая и октадецилбензоакриловая кислоты) и PLC (неомицин) не оказывали эффекта на стимулированное иономицином образование ANA, так же как и добавление арахидоновой кислоты к интактным нейронам, инкубированным с экзогеной PLD, что свидетельствует о том, что в клетках не происходила конденсация свободной кислоты с этаноламином. С другой стороны, для образования анандамидов в нестимулированных клетках существенно добавление экзогеной PLD (но не PLA2 и PLC), а инкубация синтетического [3H]N-арахидоноилфосфатидилэтаноламина и других APE с гомогенатом нейронов также приводила к образованию ANA и его аналогов, что подтверждает существование PLD ANA [93]
N- sn CoA [ Ca ]. Донорами ЖК являются фосфатидилхолин N ]. Такой путь ведет к формированию в основном этаноламидов насыщенных жирных кислот, поскольку ненасыщенные, в частности арахидоновая, кислоты в sn N-
]. Гидролиз протекал во всем исследованном диапазоне pH - от 5 до 9, активность повышалась с увеличением pH. Фермент оказался весьма специфичным как к основаниям, так и к жирным кислотам, входящим в состав N-ацилэтаноламинов [ ]. Амидаза, гидролизующая PEA, была обнаружена также в микросомах мозга собак [
Приведенные выше данные по амидазной активности тканей животных касались исключительно этаноламидов насыщенных и моноеновых жирных кислот. Из производных полиеновых ЖК, как субстрат для амидазы, исследован главным образом ANA. Амидазная активность по отношению к нему была обнаружена в препаратах клеток мозга и других тканей крысы [ ], причем наибольшая активность наблюдалась преимущественно в мембранной фракции. В сердце и мышцах она отсутствовала. Максимальная ферментативная активность наблюдалась между pH 8 и pH 9, а ниже pH 6 и выше pH10 она значительно снижалась [ PMSF IC a ( IC50=1,9 мк и этил-2-оксостеарат, также активно ингибировали гидролиз ANA, тогда как a IC IC
RBL-1-клеток обнаруживали большую активность по отношению к пальмитоилэтаноламину (Km=20 мкM) по сравнению с анандамидом (Km=67 мкM), тогда как амидазы нервных клеток (N18TG2 проявляли противоположную активность (Km=80 15 мкM PEA ANA PEA имеет большее сродст 24524v218y во к периферическим (CB2) рецепторам, а ANA - CB1 ]. Таким образом, амидазная активность предст 24524v218y авляет собой единый механизм инактивации специфических для разных тканей биологически активных модуляторов - амидированных производных ЖК (рис. 2).
ANA Km [
могут превращаться в гидроксипроизводные под действием липоксигеназ , ] ипоксигеназы различных типов проявляют неодинаковую специфичность к ANA. Так I
ANA ANA ]. Таким образом ANA ANA скую роль предст 24524v218y оит еще установить.
]. Ангиогенную активность также проявляли синтетические первичные амиды 13-транс-докозеновой кислоты и 18:0, 20:0, 22:0, 20:4w w ]
] ] ] ], ANA, CB1 и CB2 [ ] и механизм его действия еще предст 24524v218y оит изучить.
PLA2 SC0043) g PLA2 ]
Capsicum ]. Ванилинамид олеиновой кислоты (рис. 1) был активен при пероральном введении и имел меньшую токсичность по сравнению с другими аналогами. Эти эффекты, возможно, связаны с селективной блокадой чувствительных нейронов под действием ванилинамидов [
RBL-1- ], ].
ANA, олеамид) ANA, PEA ANA и PEA гидролизом APE под действием PLD сопровождается образованием фосфатидовой кислоты, которая сама по себе является важным мессенджером в клеточной регуляции (см. обзор [[121]]). Анандамид (как и THC) PLA2, что сопровождается стимулированием биосинтеза эйкозаноидов [[122]]. PLA2 ANA
Работа частично поддержана Российским фондом фундаментальных исследований (грант № 96-04-49191).
Рис. 1. Биологически активные амиды жирных кислот. ANA PEA - OLA - , ERA - эрукамид, AHT - арахидоноил-5-гидрокситриптамин, VOA - ванилинолеамид, LDA - линоле
AEA). EA - PE - фосфатидилэтаноламин, PC - фосфатидилхолин, PA - фосфатидовая кислота, APE - ацилфосфатидилэтаноламин, PLD - фосфолипаза D, FAAH -гидролаза амид ЖК, TA - трансацилаза.
bioactive amides of fatty acids
V.V.Bezuglov, m.Yu.Bobrov, A.V.Archakov
Shemyakin-Ovchinnikov Institute
of Bioorganic Chemistry RAS,
Submitted: 27 June 1997
Fatty acids amides represent a new group of lipid bioregulators originated from long-chain saturated and unsaturated fatty acids via amidation by corresponding amines. The most thoroughly investigated compounds are ethanolamides of fatty acids for those alternative biosyntetic pathway via hydrolysis of N-acylated phosphatidylethanolamines with phospholipase D was established. Ethanolamides of fatty acids bound with cannabinoid receptors in central nervous system (CB1) or in periferal tissue CB2) and are considered as endogeneous ligand for these receptors. They show pharmacological pattern like cannabimimetics. Simple amides of fatty acids are also endogeneous bioregulators acting as sleep inducing factors (oleamide) or angiogenic factors (erucamide). New group of bioregulators consists of amides of fatty acids with biologically active amines (vanillinamine, dopamine, serotonin).
Keywords: anandamide, oleamide, erucamide, ethanolamides of fatty acids, amidohydrolases, cannabinoid receptors, N-acylphosphatidylethanolamine, serotonin, dopamine
ANA - анандамид (этаноламид арахидоновой кислоты), APE - N-ацилфосфатидилэтаноламин, CB - каннабиноидный рецептор, PEA - пальмитоилэтаноламин, PLА2, PLС, PLD - фосфолипазы А2, С и D соответственно, PMSF - фенилметилсульфонилфторид, THC - D
. Muthing, J., Maurer, U., Sostaric, K., Neumann, U., Brandt, H., Duvar, S., Peter-Katalinic, J., and Weber-Schurholz, S. (1994) J. Biochem., 115, 248 -
. Kuehl, F.A. Jr., Jacob, T.A., Ganley, O.H., Ormond, R.E., and Meisinger, M.A.P. (1957) J. Am. Chem. Soc., 79, 5577 - 5578.
Devane, W.A., Hanus,
L., Breuer, A., Pertwee, R.G., Stevenson,
Cravatt, B.F., Prospero-Garcia, O., Siuzdak, G., Gilula, N.B., Henriksen, J., Boger, D.L., and Lerner, R.A. (1995) Science, 268, 1506 - 1509.
. Devane, W.A., Dysarz, F.A., III, Johnson, M.R., Melvin, L.S., and Howlet, A.C. (1988) Mol. Pharmacol., 34, 605 - 613.
. Bramblett, R.D., Panu, A.M., Ballesteros, J.A., and Reggio, H. (1995) Life Science, 56, 1971 - 1982.
. Matsuda,
. Rodríguez de Fonseca, F., Ramos, J.A., Bonnin, A., and Fernández-Ruiz, J.J (1993) Neuroreport., 4, 135 - 138.
. Bouaboula, M., Rinaldi, M., Carayon, C.,Carillon, C., Delpech, B., Shire, D., Le Fur, G., and Casellas, P. (1993) Eur. J. Biochem., 214, 173 - 180.
. Slipetz, D.M., O'Neill, G.P., Favreau, L., Dufresne, C., Gallant, M., Gareau, Y., Guay, D., Labelle M., and Metters, K.M. (1995) Mol. Pharmacol., 48, 352 - 361.
. Bayewitch, M., Avidor-Reiss, T., Levy, R., Barg, J., Mechoulam, R. and Vogel, Z. (1995) FEBS Lett., 375, 143
. Galiegue, S., Mary, S., Marchand, J., Dussossoy, D., Carriere, D., Carayon, P., Bouaboula, M., Shire, D., Le Fur, G. and Casellas, P Eur. J. Biochem
Facci, L., Dal Toso, R., Romanello, S., Buriani, A., Skaper, S.D., and Leon, A. (1995) Proc. Natl. Acad. Sci. USA, 92, 3376 - 3380.
. Pertwee, R.G., Stevenson,
. Fride, E., Barg, J., Levy, R., Saya, D., Heldman, E., Mechoulam, R., and Vogel, Z. (1995) J. Pharmacol. Exp. Ther., 272, 699 - 707.
. Priller, J., Briley, E.M., Mansouri, J., Devane, W.A., Mackie, K., and Felder, C.C. (1995) Mol Pharmacol., 48, 288 - 292.
. Vogel, Z., Barg, J., Levy, R., Saya, D., Heldman, E., and Mechoulam, R. (1993) J. Neurochem., 61, 352 - 355.
. Felder, C.C., Briley, E.M., Axelrod, J., Simpson, J.T., Mackie, K., and Devan, W.A. (1993) Proc. Natl. Acad. Sci. USA, 90, 7656 - 7660.
. Felder, C.C., Joyce, K.E., Briley, E.M., Mansouri, J., Mackie, K., Blond, O., Lai, Y., Ma, A.L., and Mitchell, R.L. (1995) Mol. Pharmacol., 48, 443 - 450
. Pinto, J.C., Potié, F., Rice, K.C., Boring, D., Johnson, M.R., Evans, D.M., Wilken, G.H., Cantrell, C.H., and Howlett, A.C. (1994) Mol. Pharmacol., 46, 516 - 522.
. Adams, I.B., Ryan, W., Singer, M., Thomas, B.F.,
. Sheskin, T., Hanus, L., Slager, J., Vogel, Z., and Mechoulam, R. (1997) J. Med. Chem., 40, 659 - 667.
. Mechoulam, R., Ben-Shabat, S., Hanus, L., Ligumsky, M., Kaminski,
N.E., Schatz, A.R., Gopher, A., Almog, S., Martin, B.R.,
. Sugiura, T., Kondo, S., Sukagawa, A., Nakane, S., Shinoda, A., Itoh, K., Yamashita, A., and Waku, K. (1995) Biochem. Biophys. Res. Commun., 215, 89 - 97.
. Mechoulam, R., Ben Shabat, S., Hanus, L., Fride, E., Vogel, Z., Bayewitch., M., and Sulcova, A.E. (1996) J. Lipid Mediators Cell Signal., 14, 45 - 49.
.
. Smith, P.B.,
. Romero, J., García, L., Cebeira, M., Zadrozny, D., Fernández-Ruiz, J.J., and Ramos, J.A. (1995) Life Sci., 56, 2033 - 2040.
. Cadas, H., Gaillet, S., Beltramo, M., Venance, L., and Piomelli, D. (1996) J. Neurosci., 16, 3934 - 3942.
Hansen, H.S.,
Lauritzen, L.,
. Varga, K.,
. Ishac, E.J., Jiang, L., Lake, K.D., Varga, K., Abood, M.E., and Kunos, G. (1996) Br. J. Pharmacol., 118, 2023 - 2028.
. Bisogno, T., Ventriglia, M., Milone, A., Mosca, M., Cimino, G., and Di Marzo, V. (1997) Biochim. Biophys. Acta, 1345, 338 - 348.
. Sugiura, T., Kondo, S., Sukagawa, A., Tonegawa, T., Nakane, S., Yamashita, A., and Waku, K. (1996) Biochem. Biophys. Res. Commun., 218, 113 -
. Epps, D.E., Palmer, J.W., Schmid, H.H.O., and Pfeiffer, D.R. (1982) J. Biol. Chem., 257, 1383 - 1391.
. Colodzin, M., Bachur, N.R., Weissbach, H. and Udenfriend, S. (1963) Biochem. Biophys. Res. Commun., 10, 165 - 170.
. Schmid, P.C., Zuzarte-Augustin, M.L., and Schmid, H.H.O (1985) J. Biol. Chem., 260, 14145 - 14149.
. Epps, D.E., Schmid, P.C., Natarajan, V., and Schmid, H.H.O. (1979) Biochem. Biophys. Res. Commun., 90, 628 - 633.
. Epps, D.E., Natarajan, V., Schmid, P.C., and Schmid, H.H.O. (1980) Biochim. Biophys. Acta, 618, 420 - 430.
. Natarajan, V., Reddy, P.V., Schmid, P.C., and Schmid, H.H.O. (1981) Biochim. Biophys. Acta, 664, 445 - 448.
. Schmid, P.C., Reddy, P.V., Natarajan, V., and Schmid, H.H.O. (1983) J. Biol. Chem., 258, 9302 - 9306.
. Natarajan, V., Schmid, P.C., Reddy, P.V., and Schmid, H.H.O. (1984) J. Neurochem., 42, 1613 - 1619.
. Di Marzo, V.,
Sugiura, T , Kondo, S , Sukagawa, A , Tonegawa, T , Nakane, S , Yamashita, A , Ishima, Y , and Waku, K (1996) Eur. J. Biochem.,
. Reddy, P.V., Schmid, P.C., Natarajan, V., and Schmid, H.H.O (1983) Biochim. Biophys. Acta, 751, 241 - 246.
. Omeir, R.L., Chin, S., Hong, Y., Ahern, D.G., and Deutsch, D.G. (1995) Life Science, 56, 1999 - 2005.
. Deutsch, D.G., Lin, S., Hill, W.A.G., Morse, K.L., Salehani, D., Arreaza, G., Omeir, R.L., and Makriyannis, A. (1997) Biochem. Biophys. Res. Commun., 231, 217 - 221.
. Pertwee, R.G., Fernando, S.R.,
. Koutek, B., Prestwich, G.D., Howlett, A.C., Chin, S.A., Salehani, D., Akhavan, N., and Deutsch, D.G. (1994) J. Biol. Chem., 269, 22937 - 22940.
. Deutsch, D.G., Omeir, R., Arreaza, G., Salehani, D., Prestwich, G.D., Huang, Z., and Howlett, A. (1997) Biochem. Pharmacol., 53, 255 - 260.
. Maurelli, S., Bisogno, T., De Petrocellis, L., Di Luccia, A., Marino, G., and Di Marzo, V. (1995) FEBS Lett., 377, 82 - 86.
. Cravatt, B.F., Giang, D.K., Mayfield, S.P., Boger, D.L., Lerner, R.A., and Gilula, N.B. (1996) Nature, 384, 83 - 87.
. Bisogno, T , Maurelli, S., Melck, D., De Petrocellis, L., and Di Marzo, V. (1997) J. Biol. Chem., 272, 3315 - 3323.
Ueda, N., Yamamoto, K., Yamamoto, S., Tokunaga, T., Shirakawa, E., Shinkai, H., Ogawa, M., Sato, T., Kudo, I., Inoue, K., et al. (1995) Biochim Biophys. Acta.
. Wakamatsu, K., Masaki, T., Itoh, F., Kondo, I., and Sudo, K. (1990) Biochem. Biophys. Res. Commun., 168, 423 - 429.
Mitchell, C A , Davies, M J , Grounds, M D , McGeachie, J K , Crawford, G J , Hong, Y , and Chirila, T J Biomat Appl
. Sugiura, T., Kondo, S., Kodaka, T., Tonegawa, T., Nakane, S., Yamashita, A., Ishima, Y., and Waku, K. (1996) Biochem. Mol. Biol. Int., 40, 931 - 938.
Maurelli, S., Bisogno, T., De Petrocellis, L., Di Luccia, A., Marino, G., and Di Marzo, V. (1995) FEBS Lett., 377, 82 - 86.
. Jain, M.K., Ghomashchi, F., Yu, B.-Z., Bayburt, T., Murphy, D., Houck, D., Brownell, J., Reid, J.C., Solowiej, J.E., Wong, S-M., Mocek, U., Jarrell, R., Sasser, M., and Gelb, M.H. (1992) J.Med.Chem., 35, 3584 - 3586.
. Janusz, J.M., Buckwalter, B.L., Young, P.A., LaHann, T.R., Farmer, R.W., Kasting, G.B., Loomans, M.E., Kerckaert, G.A., Maddin, C.S., Berman, E.F., Bohne, R.L., Cupps, T.L., and Milstein, J.R. (1993) J. Med. Chem., 36, 2595 - 2604.
Kolocouris, N., Foscolos, G.B., Fytas, G., Sakellariou, A., Raftopoulos, C., Papadopoulou-Daifoti, Z., and Vamvakides, A. (1991) Ann. Pharm. France, 49, 99 - 110.
. Tseng, C.F., Iwakami, S., Mikajiri, A., Shibuya, M., Hanaoka, F., Ebizuka, Y., Padmawinata, K., and Sankawa, U. (1992) Chem. Pharm. Bull., 40, 396 - 400.
|