Adsorbtia pe suprafete solide
Adsorbtia gazelor pe solide
Adsorbtia este fenomenul datorat fortelor de atractie exercitate de solid asupra moleculelor de gaz, ce au drept consecinta cresterea concentratiei moleculelor de gaze pe solid fata de interiorul gazului.
Adsorbtia este favorizata de presiuni ridicate si de temperaturi scazute si este de doua tipuri:
Caracteristici:
- Adsorbtia fizica - temperaturi (T) mici
- process reversibil
- caldura de adsorbtie mica 5 10 Kcal./mol
- forte de interactiune Van der Waals intre gaz si solid (slabe)
- process instantaneu
- nespecific
- exoterm
- Adsorbtia chimica - temperaturi mari necesita energie de activare
- process ireversibil
- caldura de adsorbtie 10 100 kcal/mol
- forte de atractie mari legaturi chimice
- proces exoterm
- specific
Ecuatii ce descriu fenomenul de adsorbtie
Ec. FREUNDLICH
Ecuatie empirica ce da variatia adsorbtiei cu presiunea sau concentratia.
![]() = a*p1/n (1)
= a*p1/n (1)
x = masa de gaz (moli)
m = masa de support (g)
p = presiunea de echilibru (atm)
a,n = constante ce depend de natura gazului si a solidului si se determina graphic./
Prin logaritmarea ec.(1) rezulta:
lg![]() = lg a
= lg a ![]() lg p (2) si rezulta a si n din
grafic
lg p (2) si rezulta a si n din
grafic
![]()
![]()
 lg
lg![]()
![]() tg
tg ![]() =
= ![]()
![]()
![]()
lg p
![]() lg a
lg a
Testarea valorilor experimentale
![]() Daca valorile experimentale nu se inscriu pe dreapta data
de ec.(2) rezulta ca nu e respectata ec.(1) FREUNDLICH
.
Daca valorile experimentale nu se inscriu pe dreapta data
de ec.(2) rezulta ca nu e respectata ec.(1) FREUNDLICH
.
T = ct.
 2) Ec. LANGMUIR
2) Ec. LANGMUIR ![]() ----- ----- -----------
----- ----- -----------
![]()
![]() (3)
(3)
![]()
p
a,b = constante pentru un anumit sistem si temperatura
Ecuatia (3) e stabilita considerind ca adsorbtia se face pina la o valoare limita corespunzatoare unui strat monomolecular de gaz pe suprafata S a adsorbantului.
La:
- p mici ![]() b*p<< 1
b*p<< 1![]() (3)
(3) ![]() = a*p (portiune liniara crescatoare)
= a*p (portiune liniara crescatoare)
- p mari ![]() b*p>> 1
b*p>> 1![]() (3)
(3) ![]() =
=![]() =
=![]() = ct.
= ct.
![]() = adsorbtia limita corespunzatoare formarii stratului
monomolecular
= adsorbtia limita corespunzatoare formarii stratului
monomolecular
Deci:
![]() =
=![]() =
= 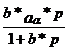 =
= ![]()
![]()
si
![]() =
= ![]()
![]() (3)
(3)
Testarea datelor experimentale si aflarea constantelor a si b:
Din (3) ![]()
![]() ;
; ![]() =
= 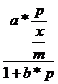
![]() =
= ![]() =
=![]() +
+![]() *p
*p
![]() =
= ![]() +
+![]() *p (4)
*p (4) ![]()
![]() =
= ![]()
Din (3) ![]() =
= ![]()
![]() ;
; ![]() =
= 
![]() =
= ![]() =
= ![]() +
+ ![]() *p
*p
![]() =
= ![]() +
+ ![]() *p (5)
*p (5) ![]() a =
a = ![]() *b
*b
Din grafic:
![]()
![]() tg
tg
![]() =
= ![]() =
= ![]()
![]()
![]()
![]()
![]()
![]()
![]() =
=![]()
p
Ec. (3) se utilizeaza si sub forma :
![]() (6)
(6)
![]() = volumul corespunzator stratului adsorbit monomolecular.
= volumul corespunzator stratului adsorbit monomolecular.
Din
(6) ![]()
![]() =
= ![]() =
= ![]() +
+![]() (7)
(7)
sau 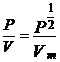 +
+![]() (8)
(8)
unde
P1/2 = presiunea
corespunzatoare la V = ![]()
![]()
3) Ec. BRUNAUER, EMMET, TELLER (B.E.T.)
Considera ca adsorbtia se face in strat multimolecular.
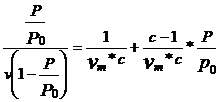 (9), unde:
(9), unde:
v = volumul de gaz adsorbit pe unitatea de masa de support la presiunea p
vm = volumul de gaz adsorbit cind suprafata e acoperita cu un strat monomolecular
c = constant ace depinde de adsorbant
p = presiunea de lucru
p0 = presiunea vaporilor saturanti
![]() (10) unde Em = caldura de adsorbtie
la formarea vm
(10) unde Em = caldura de adsorbtie
la formarea vm
Ec = caldura de condensare a gazului in lichid
Din
reprezentarea grafica, din panta dreptei si intercept ![]() vm si c
vm si c
![]()
![]()
![]()
![]()

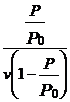
![]() tg
tg ![]() =
= ![]()
![]()
![]()
![]()
Putem calcula nr. de molecule adsorbite in stratul monomolecular :
![]() =*NA unde, NA = numarul lui Avogadro; VM = volum molar,
=*NA unde, NA = numarul lui Avogadro; VM = volum molar,
Notind![]() = sectiunea eficace (suprafata ocupata de 1 molecula
adsorbita) putem calcula suprafata de adsorbtie a suportului solid :
= sectiunea eficace (suprafata ocupata de 1 molecula
adsorbita) putem calcula suprafata de adsorbtie a suportului solid :
S = ![]() *NA*
*NA*![]() (11)
(11)
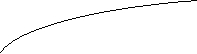
4) Izostere de adsorbtie
Se
obtin din reteaua de izoterme si constau in reprezentarea intr-o diagrama a
variatiei P = f(T) la adsorbtie ![]() = const.)
= const.)
![]() 2>
2>![]() 1
1
![]() P
P
![]()
![]()
![]() T1<T2<T3
T1<T2<T3 ![]() 2
2
 T1
= ct.
T1
= ct.

 T2
= ct
T2
= ct ![]() 1
1

T
![]()
![]()
![]()
![]()
![]()
![]() T3 = ct
T3 = ct
![]()
P1 P2 P3
P1, T1; P2,T1; P3, T3 .
(*) Se observa ca avem o variatie identica cu variatia presiunii de vapori a lichidelor cu temperatura ( ec. Clausius Clapeyron).
Facind
reprezentarea in coordonate log p = f![]() se obtine:
se obtine:
![]() lg
P
lg
P

![]() lg
P2 ----- ----- ------
lg
P2 ----- ----- ------
tg
![]() = - tg(180 -
= - tg(180 -![]() ) = Qa < 0
) = Qa < 0
![]()
![]() (caldura de adsorbtie
diferentiala)
(caldura de adsorbtie
diferentiala)
![]()
![]() lg
P1
lg
P1
![]()
![]()
![]()
![]()
Caldura
de adsorbtie poate fi diferentiala sau integrala si este functie de gradul de acoperire al adsorbantului![]() .
.
Pornind
de la starea in care pe toata suprafata S (respectiv m grame
adsorbent) se gasesc ![]() moli de substanta adsorbita si se mai adsorb d
moli de substanta adsorbita si se mai adsorb d![]() moli in urma cresterii diferentiale a presiunii gazului,
caldura diferentiala de adsorbtie este:
moli in urma cresterii diferentiale a presiunii gazului,
caldura diferentiala de adsorbtie este:
Qa = ![]() (12) ,
unde q = cantitatea totala de caldura masurata.
(12) ,
unde q = cantitatea totala de caldura masurata.
Caldura
integrala de adsorbtie ![]() corespunde la o adsorbtie de
corespunde la o adsorbtie de ![]() moli de gaz pe o suprafata initial goala:
moli de gaz pe o suprafata initial goala:
![]() =
=  d
d![]() (13)
(13)
La
echilibrul care se stabileste intre gazul(liber) ![]() gazul(adsorbit) trebuie sa avem :
gazul(adsorbit) trebuie sa avem :
![]() =
= ![]() (14)
(14)
![]() = potentialul chimic al gazului adsorbit
= potentialul chimic al gazului adsorbit
![]() = potentialul chimic
al gazului liber
= potentialul chimic
al gazului liber
![]() = f ( T,
= f ( T, ![]() ) (15) ;
) (15) ; ![]() = f(T, P) (16)
= f(T, P) (16)
Trebuie sa avem : d![]() = d
= d![]() (17)
(17)
![]()
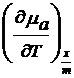 dT +
dT + 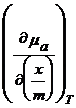 d(
d(![]() ) =
) = 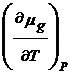 dT +
dT + 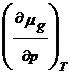 dP (18)
dP (18)
dar
![]() = ct. ; d(
= ct. ; d(![]() ) = 0
) = 0
Pentru un singur
component gazos ![]() = G (19) si
= G (19) si ![]() = -S (20) iar G = H
T*S (21).
= -S (20) iar G = H
T*S (21).
Din (20) si (21) ![]()
![]() = -S =
= -S = ![]() (22)
(22)
(18) devine:
![]() -
-![]() =
= 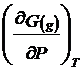 *
* (19)
(19)
![]() dar din (14)
dar din (14) ![]() =
= ![]()
si din (19) ![]() = G
= G ![]()
![]() =
= ![]() ; iar
; iar 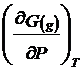 =
= ![]()
Deci (19) devine - ![]() =
= ![]() *
*![]() (20)
(20)
Dar ![]() -
- ![]() =
= ![]() (21) si (20) rezulta:
(21) si (20) rezulta:
 = -
= -![]() (22)
(22)
![]() = caldura de adsorbtie
si din cauza conditiei
= caldura de adsorbtie
si din cauza conditiei ![]() = ct., caldura diferentiala partial molara de adsorbtie, sau
:
= ct., caldura diferentiala partial molara de adsorbtie, sau
:
![]() =
= ![]() = constant (23)
= constant (23)
sau formula integrata :


P2> P1 T2 > T1 ![]()
![]() < 0
< 0
Ec.
(24) este similara ec. Clausius Clapeyron pentru echilibrul L![]() V aplicata pentru condensare.
V aplicata pentru condensare.
![]() ln
P
ln
P
![]() ln
P2 ----- ----- ------
ln
P2 ----- ----- ------
tg
![]() = - tg(180 -
= - tg(180 -![]() ) = Qa/RT
) = Qa/RT
![]()
![]() Qa < 0
Qa < 0
![]() ln
P1 -------- ----- ------ ---------- fenomen exoterm deoarece in cadranul
II tg
ln
P1 -------- ----- ------ ---------- fenomen exoterm deoarece in cadranul
II tg ![]() < 0
< 0
![]()
![]()
![]()
![]()
5) Izobare de adsorbtie
La p = ct. adsorbtia ![]() scade cu cresterea
temperaturii (T) si anume in prima aproximatie exponential (graficul
scade cu cresterea
temperaturii (T) si anume in prima aproximatie exponential (graficul ![]() = f (T))
= f (T))

![]()
![]()
 P2
> P1
P2
> P1
P2 = ct.
P1 = ct.
![]() T
T
Se pleaca de la ecuatia (17) in care in acest caz dp 0 si rezulta :
![]()
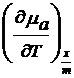 dT +
dT + 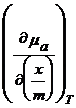 d(
d(![]() ) -
) -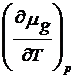 dT = 0 (25)
dT = 0 (25)
Trebuie
gasita valoarea 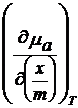
Se considera ca substanta (gazul) se comporta ideal:
![]() =
= ![]() 0 + RT*ln(
0 + RT*ln(![]() ) (26)
) (26)
si
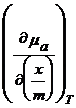 =
= ![]() (27) si
rezulta din (27) :
(27) si
rezulta din (27) :![]()
 =
= ![]() (28)
(28)
Ec.(28) este similara ec. Clausius Clapeyron pentru vaporizare sau izobarei de reactie vant Hoff.
Daca
se presupune ca ![]() nu depinde de T si
nu depinde de T si ![]() (aproximatie grosolana pe un interval larg de temperatura)
rezulta :
(aproximatie grosolana pe un interval larg de temperatura)
rezulta :
ln ![]() = -
= - ![]() + const.
+ const.
sau prin integrare :
ln  =
= 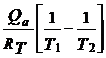 (30)
(30)
Qa
< 0 ![]() ca adsorbtia
ca adsorbtia ![]() scade cu cresterea
temperaturii (T).Din reprezentarea grafica se obtine Qa.
scade cu cresterea
temperaturii (T).Din reprezentarea grafica se obtine Qa.
![]() ln x/m
ln x/m
 tg
tg
![]() = - Qa / R > 0
= - Qa / R > 0![]() Qa < 0
Qa < 0
![]() ln (x/m)2 -------- ----- ------ -
ln (x/m)2 -------- ----- ------ -
![]()
![]()
![]() ln (x/m)1 -------- ----- ------ ----------
ln (x/m)1 -------- ----- ------ ----------
![]()
![]()
![]()
![]()
6) Adsorbtia din solutie pe suprafete solide
Respecta legea empirica a lui FREUNDLICH :
-
la T = ct. ![]() = k*
= k*![]() (31) ,
unde:
(31) ,
unde:
x = grame de substanta adsorbita
m = masa de adsorbant
Cech = concentratia la echilibru
k,n = constante ce se determina din grafic
Testarea datelor experimentale si determinarea constantelor k si n:
Se logaritmeaza ec. (31) si rezulta:
lg ![]() = lg k +
= lg k + ![]() lg
lg ![]() (32)
(32)
Ec. (32) se reprezinta grafic :
![]()
 lg
lg![]() +
+
![]() +
+ ![]() tg
tg ![]() =
= ![]()
![]() +
+
.
.
![]()
lg k
![]()
Daca punctele experimentale se inscriu pe o dreapta, este verificata ec. (32).
x se determina astfel :
x = ![]() (mol/l)* V(l) (33)
(mol/l)* V(l) (33)
deci ec. (32) se mai poate scrie :
lg
![]() = lg k +
= lg k + ![]() lg
lg ![]() (34)
(34)
unde V(l) = volumul solutiei in litri.
|