CINETICA CHIMICA
Cinetica chimica : ramura a chimiei care se ocupa cu stabilirea vitezelor de reactie, a factorilor care influenteaza viteza si a mecanismului acestor reactii.
Teoria ciocnirilor. Complex activat. Energie de activare
Pentru ca o reactie chimica sa se produca este necesar ca o serie de legaturi sa se rupa, iar altele sa se formeze. 747f59h
Conform teoriei cinetico-moleculare particulele constituente ale materiei sunt intr-o continua miscare , avand diferite energii cinetice. Redistribuirea legaturilor chimice are loc in urma ciocnirilor dintre particulele reactante, dar nu toate ciocnirile sunt eficiente, astfel incat sa se formeze produsi de reactie.
Pentru ca ciocnirile sa fie eficiente trebuie indeplinite doua conditii:
energia cinetica a particulelor reactante sa fie suficient de mare pentru a se produce ruperea legaturilor chimice( conditia energetica)
moleculele sa aiba orientare favorabila pentru a se putea forma complexul activat( conditia geometrica)
In cazul in care sunt satisfacute aceste conditii are loc reactia chimica, iar prin ciocnire se formeaza o asociatie temporara bogata in energie, care se numeste complex activat.
Energia minima a particulelor necesara pentru formarea complexului activat reprezinta energia de activare.
Complexul activat pentru toate reactiile chimice este starea cu energia cea mai ridicata atat fata de reactanti cat si fata de produsi.
Viteza de reactie este marimea care indica variatia concentratiei reactantilor sau produsilor in unitatea de timp.
![]() a) Viteza medie de reactie
a) Viteza medie de reactie
![]() Viteza de reactie
Viteza de reactie
b) Viteza reala de reactie
a) Viteza medie de reactie se poate exprima ca raportul dintre variatia concentratiei unei substante intr-un interval de timp
Matematic se exprima astfel: v = - Dc/Dt (moli/sec)
b) Viteza reala de reactie se exprima ca diferentiala concentratiei in functie de timp si reprezinta viteza pe care o are reactia la un moment dat
Matematic se exprima astfel: vr = - dc/dt
Nr.molii
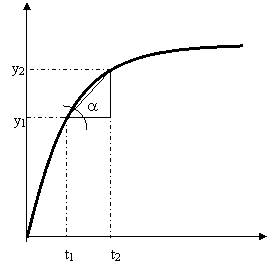 y2 – y1 = D C ; t2-t1 = DT;
y2 – y1 = D C ; t2-t1 = DT;
tgBAC = BC/AB = y2-y1/t2-t1 tga D C DT = v
Timp
2.1. Legea vitezei
Vitezele cu care se consuma reactantii sau cu care se formeaza produsii sunt proportionale cu coeficientii stoechiometrici.
Pentru reactia : aA + bB = cC + dD avem vA/a = vB/b = vC/c = vD/d
a, b, c, d = coeficienti stoechiometrici
Pentru acest tip de reactie viteza va depinde de concentratiile lui A si B la anumite puteri si de o serie de alti factori cum ar fi: temperatura, presiunea, catalizatorii. Actiunea tuturor acestor factori se inglobeaza intr-o constanta k , denumita constanta de viteza.
Legea vitezei : viteza unei reactii chimice este proportionala cu produsul concentratiilor reactantilor ridicate la o putere egala cu coeficientii stoechiometrici ai reactiei si cu constanta de viteza a reactiei.
Viteza de reactie se va exprima prin relatia:
V = k x A nA B nB nA, nB = ordine partiale de reactie
k = constanta de viteza sau viteza specifica este o proprietate caracteristica si constanta a unei reactii, permitand compararea vitezelor diferitelor reactii.
Aceasta lege este valabila numai pentru reactiile care au loc in faza omogena, adica atunci cand reactantii se afla in solutie sau in stare gazoasa.
Factorii care influenteaza viteza de reactie
a) Temperatura : cresterea temperaturii produce o crestere considerabila a vitezei particulelor, deci a energiei cinetice. Numarul ciocnirilor eficace creste in unitatea de timp, deci viteza procesului creste de asemenea.
b) Concentratia reactantilor: prin marirea concentratiei unuia dintre reactanti, numarul particulelor din unitatea de volum creste, deci probabilitatea ca acestea sa se ciocneasca in unitatea de timp este mai mare si in consecintaviteza de reactie creste cu marirea concentratiei.
c) Catalizatorii: sunt substante care modifica viteza reactiilor chimice, actionand asupra mecanismului lor si se regasesc cantitativ la sfarsitul reactiei. Catalizatorii micsoreaza valoarea energiei de activare, ceea ce conduce la cresterea vitezei.
Mecanismul de actiune al catalizatorilor
Reactia generala necatalizata: A + B Produsi
Reactia generala catalizata A + cat A-cat
A-cat + B Produsi + cat
A-cat = complex format prin adsorbtie fizica intre reactant si catalizator
Proprietatile catalizatorilor:
micsoreaza energia de activare a moleculelor reactantilor;
micsoreaza temperatura de reactie;
maresc viteza de reactie in ambele sensuri, grabind stabilirea echilibrului ;
actioneaza in cantitati mici, care nu sunt in raporturi stoechiometrice cu substantele pe care le catalizeaza;
prezinta selectivitate, adica favorizeaza numai una din mai multe reactii posibile.
In functie de starea de agregare a catalizatorilor si a reactantilor, deosebim cataliza omogena (cand catalizatorul si reactantii formeaza un sistem omogen- solutie sau faza gazoasa) si cataliza heterogena (catalizatorul si reactantii se afla in stari de agregare diferite).
|