Decarboxilarea oxidativa a piruvatului (Pyr) are loc în matricea mitocondriala sub actiunea catalitica a complexului, multienzimatic piruvat dehidrogenaza (Pyr-DH) si este etapa premergatoare a ciclului citric. În afara de NADH procesul produce si acetilCoA. În mitocondrie una din principalele cai catabolice care consuma acest compus este ciclul citric. El fiind cea mai importanta cale de producere de NADH si FADH2, care se vor oxida în lantul respirator. Decarboxilarea oxidativa se mai întâlneste în cadrul ciclului citric în transformarea a-cetoglutratului în succinil CoA. De asemenea degradarea scheletelor mai multor aminoacizi cum ar fi valina, leucina , izoleucina implica decarboxilari oxidative ale a-cetoacizilor, rezultati prin transaminare.
Agregatul care catalizeaza decarboxilarea oxidativa a piruvatului consta din copii multiple a 3 enzime:
-E1, piruvat dehidrogenaza cu coenzima TPP atasata prin forte coulombiene,
-E2, dihidrolipoil transacetilaza cu coenzima lipoamida legata covalent si coenzima A care nu se recicleaza si
-E3, dihidrolipoil dehidrogenaza cu coenzima FAD si coenzima NAD+, cea din urma fiind nereciclabila.
În timpul decarboxilarii oxidative, proces cu mai multe etape, intermediarii ramân legati de c 929g68j omplex, cu urmatoarele avantaje:
complexul este capabil sa transfere intermediarii între centrele active ale enzimelor E1, E2, E3 în ordinea în care urmeaza sa reactioneze, ceea ce mareste eficienta cinetica si termodinamica a procesului.
distantele pe care intermediarii trebuie sa le parcurga prin difuzie sunt micsorate, adica viteza procesului este crescuta.
Cinetica acestui proces este îmbunatatita, ca urmare a "pendularii bratului flexibil" de lipoil-lizil între centrele active ale E1 si E3 pentru a transfera gruparea acetil si doi electroni de la piruvat la coenzima A, respectiv FAD.
De remarcat faptul ca structurile complexelor decarboxilarii oxidative a altor a-cetoacizi au tot 3 enzime ce contin aceleasi coenzime si catalizeaza aceleasi tipuri de reactii.
 Piruvatul
produs în citosol de glicoliza traverseaza membrana
mitocondriala interna prin intermediul unui symport specific piruvat
- H+. Conversia în acetil-CoA se face printr-o secventa de
5 reactii.
Piruvatul
produs în citosol de glicoliza traverseaza membrana
mitocondriala interna prin intermediul unui symport specific piruvat
- H+. Conversia în acetil-CoA se face printr-o secventa de
5 reactii.

 Reactia 1 Prin decarboxilare se pierde atomul C(1) al piruvatului.
Aceasta reactie este catalizata de piruvat dehidrogenaza (E1)
si coincide cu etapa de formare a hidroxietil-TPP.
Reactia 1 Prin decarboxilare se pierde atomul C(1) al piruvatului.
Aceasta reactie este catalizata de piruvat dehidrogenaza (E1)
si coincide cu etapa de formare a hidroxietil-TPP.
În reactia 2 tot sub actiunea enzimei E1 are loc oxidarea gruparii hidroxietil pâna la acetat. Cei doi electroni rezultati prin oxidare reduc puntea disulfurica la doua grupari tiol una din ele fiind esterificata cu acetat. Se regenereaza astfel TPP·E1, care poate relua reactia 1.
 În reactia 3 enzima dihidrolipoil
transacetilaza (E2) catalizeaza transferul gruparii acetil
de la acetildihidrolipoamida-E2 la CoASH rezultând principalul
produs al procesului, acetil-CoA. Energia necesara formarea tioesterului
macroergic, este furnizata de oxidarea hidroxietilului.
În reactia 3 enzima dihidrolipoil
transacetilaza (E2) catalizeaza transferul gruparii acetil
de la acetildihidrolipoamida-E2 la CoASH rezultând principalul
produs al procesului, acetil-CoA. Energia necesara formarea tioesterului
macroergic, este furnizata de oxidarea hidroxietilului.
 Reactia 4 este catalizata
de dihidrolipoil dehidrogenaza (E3) care contine o
legatura disulfurica reductibila la doua grupari
tiol ceea ce regenereaza lipoamida-E2 care apoi poate relua
reactia 2. Astfel cei doi electroni pot trece de la E2 la E3.
Reactia 4 este catalizata
de dihidrolipoil dehidrogenaza (E3) care contine o
legatura disulfurica reductibila la doua grupari
tiol ceea ce regenereaza lipoamida-E2 care apoi poate relua
reactia 2. Astfel cei doi electroni pot trece de la E2 la E3.
 Reactia 5, catalizata tot de E3, consta în
trecerea electronilor de la E3 la NAD+ prin intermediul
FAD, produsul net fiind NADH. Astfel, E3-FAD regenerata poate
relua reactia 4.
Reactia 5, catalizata tot de E3, consta în
trecerea electronilor de la E3 la NAD+ prin intermediul
FAD, produsul net fiind NADH. Astfel, E3-FAD regenerata poate
relua reactia 4.
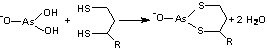 Arsenitul este o otrava pentru complexul Pyr-DH
datorita capacitatii lui de a se lega covalent la
dihidrolipoamida:
Arsenitul este o otrava pentru complexul Pyr-DH
datorita capacitatii lui de a se lega covalent la
dihidrolipoamida:
Conform reactiei este inhibata lipoamida-E2 din compozitia piruvat dehidrogenazei si a-cetoglutarat, dehidrogenazei. Otravirea decarboxilarilor oxidative este de fapt inhibitia unei etape, timpurii a respiratiei celulare. Compusii pe baza de arsen sunt mai toxici fata de microorganisme decât fata de oameni. Aceasta diferenta a fost folosita pentru terapia unor boli cum ar fi sifilisul (care acum se trateaza actualmente cu antibiotice) si alte treponozomiaze (treponozomii sunt boli provocate de bacterii din familia Treponemataceae). Acesti compusi arseno-organici au fost printre primele antibiotice, ei prezentând însa severe efecte secundare.
Mecanismele prin care este controlata decarboxilarea oxidativa a piruvatului sunt urmatoarele:
Acetil-CoA si NADH în exces încetinesc reactiile actionând direct asupra procesului de decarboxilare oxidativa. Excesul de acetil-CoA blocheaza enzima E2 prin mentinerea ei în forma acetilata (acetil-dihidrolipoamida-E2), incapabila sa accepte gruparea hidroxietil de la hidroxietil-TPP·E1 care ramâne blocata în aceasta forma. Aceasta înseamna ca sunt blocate reactiile 2 si 3. NADH în exces blocheaza enzima E3 prin mentinerea ei în forma redusa, incapabila sa accepte cei doi electroni de la coenzima enzimei E2 care ramâne blocata sub forma acetilat. Aceasta înseamna ca sunt blocate reactiile 2-5. Întrucât cantitatea de E1 este mica se va acumula piruvatul.
Global, încetinirea decarboxilarii oxidative a piruvatului prin inhibitie prin produsi va reduce producerea acestora (CH3COSCoA si NADH) si deci excesul lor se va diminua. Controlul activitatii Pyr-DH intereseaza si reglarea concomitenta a glicolizei si gluconeogenezei.
 Enzima E1 si în
consecinta complexul Pyr-DH devin inactive atunci când un radical de
serina al E1 este fosforilat cu ATP sub actiunea
catalitica a unei kinaze. Fosforilarea este activata de aceiasi
metaboliti ca si în cazul inhibitiei prin produsi. Enzima E1
fosforilata este reactivata prin hidroliza gruparii fosforil sub
actiunea catalitica a unei fosfataze, stimulatori fiind ionii Ca2+
si Mg2+. Aceeasi ioni activeaza E1 prin
inhibarea fosforilarii ei.
Enzima E1 si în
consecinta complexul Pyr-DH devin inactive atunci când un radical de
serina al E1 este fosforilat cu ATP sub actiunea
catalitica a unei kinaze. Fosforilarea este activata de aceiasi
metaboliti ca si în cazul inhibitiei prin produsi. Enzima E1
fosforilata este reactivata prin hidroliza gruparii fosforil sub
actiunea catalitica a unei fosfataze, stimulatori fiind ionii Ca2+
si Mg2+. Aceeasi ioni activeaza E1 prin
inhibarea fosforilarii ei.
Ciclul citric mai poarta numele de Ciclul Krebs, dupa numele (Hans Krebs) celuia care în 1937 a postulat existenta lui. Hans Krebs împreuna cu Fritz Lipmann au primit premiul Nobel în 1953 pentru descoperirea ciclului citric si respectiv descoperirea Coenzimei A si a ciclului ATP-ului. De asemenea ciclul citric este cunoscut si sub numele de Ciclul acizilor tricarboxilici, având în vedere implicarea acestor acizi în ciclu.
Întregul echipament enzimatic al ciclului citric se gaseste în matricea mitocondriala cu exceptia succinat dehidrogenazei care este "îngropata", în membrana interna. Etapele ciclului sunt:
 1)
Sinteza citratului este o condensare aldolica dintre acetil-CoA si o
cetona având ca intermediar citril-CoA care hidrolizeaza. Reactia
este catalizata de citrat sintaza. Denumirea de sintaza este data unei enzime care catalizeaza o
condensare aldolica. Alte condensari aldolice sunt catalizate de
aldolaze (vezi glicoliza si fructozoliza). Atât sintazele cât si
aldolazele catalizeaza reactii cu formare de legaturi C-C
fara consum de ATP sau alt compus macroergic. Sintetazele catalizeaza reactii de condensare în care legaturile
covalente se formeaza pe seama energiei furnizate de ATP sau alti
nucleozid trifosfati.
1)
Sinteza citratului este o condensare aldolica dintre acetil-CoA si o
cetona având ca intermediar citril-CoA care hidrolizeaza. Reactia
este catalizata de citrat sintaza. Denumirea de sintaza este data unei enzime care catalizeaza o
condensare aldolica. Alte condensari aldolice sunt catalizate de
aldolaze (vezi glicoliza si fructozoliza). Atât sintazele cât si
aldolazele catalizeaza reactii cu formare de legaturi C-C
fara consum de ATP sau alt compus macroergic. Sintetazele catalizeaza reactii de condensare în care legaturile
covalente se formeaza pe seama energiei furnizate de ATP sau alti
nucleozid trifosfati.
2) Transformarea citratului în isocitrat se face prin intermediul compusului instabil cis-aconitat. În a doua etapa, prin hidratarea cis-aconitatului rezulta isocitrat. Pentru ambele reactii
enzima este aconitaza. Daca aceasta reactie ar fi neenzimatica ar rezulta 4 stereoizomeri. Totusi, întrucât aconitaza este o enzima stereospecifica, aditia apei produce numai stereoizomerul (2R, 3S)-isocitrat. Ionul de Fe2+ joaca un rol deosebit în aceasta reactie, el formeaza cu citratul un chelat
(complex intern) stabil. Acest chelat este necesar pentru activitatea enzimei. Doze mari de fluoruri, fac ca fluorul sa reactioneze cu acidul citric, implicat în ciclul Krebs, având drept urmare formarea acidului monofluorocitric care nemaiputând participa la reactiile ciclului citric, întrerupe ciclul, deci producerea de energie, consecinta este moartea celulei. De asemenea acidul monofluorocitric este un inhibitor puternic al aconitazei.

 3)
Transformarea izocitratului în a cetoglutarat (aCG) elibereaza prima
molecula de CO2 a ciclului.
3)
Transformarea izocitratului în a cetoglutarat (aCG) elibereaza prima
molecula de CO2 a ciclului.
Enzima izocitrat dehi-drogenaza catalizeaza o reactie în doua etape având ca intermediar instabil oxalo-succinatul. Exista doua izoenzime ale izocitrat dehidrogenazei. Cea implicata în ciclul citric este NAD dependenta si se gaseste numai în matricea mitocondriala. Cealalta este NADP dependenta se gaseste atât în matricea mitocondriala cât si în citosol, unde produce NADPH necesar proceselor anabolice.
 4)
Decarboxilarea oxidativa a aCG elibereaza cea de a doua molecula
de CO2.
4)
Decarboxilarea oxidativa a aCG elibereaza cea de a doua molecula
de CO2.
Catalizator este complexul multienzimatic a-cetoglutarat-DH, similar complexului Pyr-DH. Acest complex este format din urmatoarele subunitati enzimatice: a-cetoglutarat dehidrogenaza (E1), dihidrolipoil transsuccinaza (E2) si dihidrolipoil dehidrogenaza (E3).
5) Conversia succinil-CoA în succinat. Enzima, succinil-CoA sintetaza se mai numeste succinat tiokinaza în functie de sensul în care este citita reactia. Se stie ca la animale aceasta enzima foloseste GDP ca substrat iar la plante si bacterii foloseste ADP. Formarea cuplata a GTP (sau ATP) pe seama energiei eliberate prin decarboxilarea oxidativa a aCG este un exemplu de fosforilare la nivel de substrat. Fosforilarea la nivel de substrat implica enzime solubile pe când fosforilarea oxidativa implica enzime legate de membrana interna mitocondriala. Pe seama energiei legaturii tioesterice se produce direct o legatura macroergica fosfat. Simultan are loc fosforilarea ADP în reactie cu GTP: GTP + ADP→ATP + GDP
 Pâna
în acest punct al ciclului s-au generat doua molecule de NADH si una
de ATP (din GTP).
Pâna
în acest punct al ciclului s-au generat doua molecule de NADH si una
de ATP (din GTP).
 6)
Dehidrogenarea succinatului este catalizata de succinat
dehidrogenaza, o flavoproteina. Succinat-DH la eucariote este singura
enzima a ciclului citric care este asociata adânc la membrana
interna mitocondriala. Enzima contine câteva complexe [Fe-S]
care intermediaza trecerea electronilor de la FADH2 la transportorii
de electroni ai lantului respirator
(vezi capitolul oxidarea biologica).
6)
Dehidrogenarea succinatului este catalizata de succinat
dehidrogenaza, o flavoproteina. Succinat-DH la eucariote este singura
enzima a ciclului citric care este asociata adânc la membrana
interna mitocondriala. Enzima contine câteva complexe [Fe-S]
care intermediaza trecerea electronilor de la FADH2 la transportorii
de electroni ai lantului respirator
(vezi capitolul oxidarea biologica).
 7)
Hidratarea fumaratului cu formare de malat este catalizata de
fumaraza
7)
Hidratarea fumaratului cu formare de malat este catalizata de
fumaraza
Fumaraza care are specificitate absoluta adica ea catalizeaza hidratarea fumaratului nu si a maleatului, izomerul cis al fumaratului. În sens invers fumaraza catalizeaza numai deshidratarea L-malatului nu si a D-malatului.
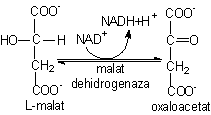 8)
Oxidarea L-malatului cu refacerea oxalacetatului (OA) este catalizata de
malat dehidrogenaza. Desi aceasta reactie este
endergonica (DG°' = + 29,7 kJ/mol), ea este deplasata in vivo spre dreapta datorita
îndepartarii rapide a produsilor de reactie, oxalacetatul
în reactia 1 si NADH oxidat în latul respirator.
8)
Oxidarea L-malatului cu refacerea oxalacetatului (OA) este catalizata de
malat dehidrogenaza. Desi aceasta reactie este
endergonica (DG°' = + 29,7 kJ/mol), ea este deplasata in vivo spre dreapta datorita
îndepartarii rapide a produsilor de reactie, oxalacetatul
în reactia 1 si NADH oxidat în latul respirator.
Reglarea ciclului citric asigura producerea de intermediari si produsi astfel încât sa mentina starea de echilibru a celulelor si pentru a evita supraproductia neeconomica de metaboliti. Enzimele cheie ale ciclului citric sunt controlate aproape exclusiv pe 3 cai simple A) disponibilitatea substratului B) inhibitia prin acumulare de produsi, C) feed back negativ competitiv
Cele 3 enzime cheie: (a) citrat sintaza, (b) isocitrat dehidrogenaza, (c) a-cetoglutarat dehidrogenaza.
 Astfel,
disponibilitatea substraturilor
citrat sintazei (acetil-CoA si oxalacetatul, care este substrat si
catalizator) variaza în functie de conditiile metabolice si
uneori aceasta limiteaza viteza de formare a citratului. Pe de alta
parte, NADH rezultat la oxidarea isocitratului si a a cetoglu-taratului (si
malatului) se poate acumula în anumite conditii. Daca raportul
[NADH]/[NAD+] din mitocondrie devine mare vitezele reactiilor
de oxidare ale intermediarilor aratati se micsoreaza în
conformitate cu legea actiunii maselor.
Astfel,
disponibilitatea substraturilor
citrat sintazei (acetil-CoA si oxalacetatul, care este substrat si
catalizator) variaza în functie de conditiile metabolice si
uneori aceasta limiteaza viteza de formare a citratului. Pe de alta
parte, NADH rezultat la oxidarea isocitratului si a a cetoglu-taratului (si
malatului) se poate acumula în anumite conditii. Daca raportul
[NADH]/[NAD+] din mitocondrie devine mare vitezele reactiilor
de oxidare ale intermediarilor aratati se micsoreaza în
conformitate cu legea actiunii maselor.
În mod similar, oxidarea malatului este la echilibru în conditii fiziologice. De aceea atunci când raportul [NADH]/[NAD+] este crescut concentratia oxalacetatului este scazuta datorita deplasarii echilibrului reactiei catre malat. Din aceasta cauza este încetinita prima reactie a ciclului datorita lipsei de disponibilitate a substratului, oxalacetatul.
Acumularea de produsi inhiba toate cele 3 etape limitatoare de viteza. Succinil-CoA inhiba complexul multienzimatic aCG-DH. Citratul blocheaza citrat sintaza iar produsul final ATP inhiba izocitrat-DH. Inhibitia sintazei de catre succinil-CoA este o reglare prin feed-back competitiv în care inhibitorul intra în competitie cu acetil-CoA la centrul activ al sintazei. Ionii de calciu activeaza printr-un mecanism alosteric izocitrat-DH, si aCG-DH dar si complexul multienzimatic Pyr-DH.
În concluzie, concentratiile intermediarilor ciclului citric regleaza fluxul metabolic al ciclului astfel încât acesta sa furnizeze ATP si NADH pentru mentinerea lor la concentratii optime indiferent de intensitatea lantului de oxidare biologica.
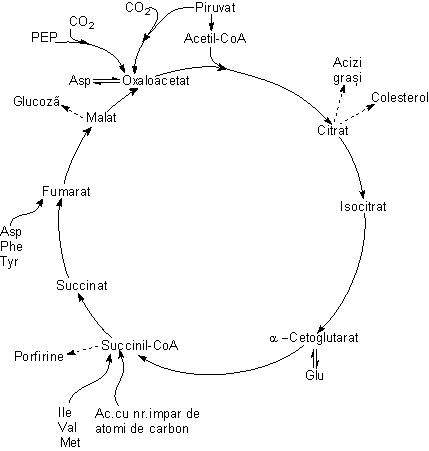 În
mod obisnuit se crede ca o cale metabolica este fie
catabolica, necesara eliberarii (conservarii) energiei libere,
fie anabolica necesara sintezei biomoleculelor cu consum de energie
libera (ATP). Ciclul citric are un caracter catabolic deoarece el
degradeaza unitati acetil fiind unul din principalele procese
ale energogenezei. Este necesar ca intermediarii ciclului sa se
mentina la concentratii suficient de mari pentru a asigura
functionarea lui. Însa exista mai multe cai metabolice care
utilizeaza intermediari ciclului citric (scazând astfel
concentratia lor), ca materiale de pornire în sinteze (anabolism). De
aceea acest ciclu are un caracter dublu, catabolic si anabolic, adica
amfibolic.
În
mod obisnuit se crede ca o cale metabolica este fie
catabolica, necesara eliberarii (conservarii) energiei libere,
fie anabolica necesara sintezei biomoleculelor cu consum de energie
libera (ATP). Ciclul citric are un caracter catabolic deoarece el
degradeaza unitati acetil fiind unul din principalele procese
ale energogenezei. Este necesar ca intermediarii ciclului sa se
mentina la concentratii suficient de mari pentru a asigura
functionarea lui. Însa exista mai multe cai metabolice care
utilizeaza intermediari ciclului citric (scazând astfel
concentratia lor), ca materiale de pornire în sinteze (anabolism). De
aceea acest ciclu are un caracter dublu, catabolic si anabolic, adica
amfibolic.
Toate transformarile anabolice care utilizeaza intermediari citrici sunt consumatoare de energie libera. Din acest motiv functia catabolica a ciclului nu poate fi întrerupta. Pin urmare intermediarii scosi în scop anabolic trebuie imediat înlocuiti. Reactiile de completare a acestora se mai numesc reactii anaplerotice.
Printre reactiile anabolice se numara:
- sinteza glucozei (gluconeogeneza) care se desfasoara în citosol pe seama malatului care este transportat în afara mitocondriei prin intermediul unui sistem de transport aflat în membrana interna mitocondriala;
- biosinteza lipidelor (acizi grasi, colesterol) care are loc în citosol pornind de la acetil-CoA. Aceasta din urma nu poate traversa membrana mitocondriala decât prin intermediul navetei citrat-piruvat. Citratul mitocondrial iese în citosol iar piruvatul patrunde în mitocondrie. Sub actiunea citrat liazei citratul se transforma în acetil - CoA cu consum de energie. Acetil - CoA astfel rezultata initiaza sinteza acizilor si a colesterolului (vezi capitolul Metabolismul lipidic).
- biosinteza aminoacizilor utilizeaza intermediarii ciclului citric pe doua cai.
a. aminarea reductiva a aCG catalizata de glutamat dehidrogenaza NAD+ sau NADP+ dependenta:
aCG + NAD(P)H + NH3 ↔ Glu + NAD(P)+ + H2O
b. transaminarea la care participa aCG si oxalacetatul din rândul intermediarilor ciclului citric:
aCG + Ala ![]() Glu + Pyr
Glu + Pyr
OA +Ala ![]() Asp + Pyr
Asp + Pyr
- biosinteza hemului începe în mitocondrie utilizând ca material de pornire succinil-CoA (vezi capitolul Metabolismul proteic).
Reactiile anaplerotice reîncarca ciclul pornind de la precursori ne-citrici.
Principala reactie anaplerotica care actioneaza în ficat si rinichi este carboxilarea piruvatului catalizata de piruvat carboxilaza, enzima biotin-dependenta.
Pyr + CO2 + ATP + H2O ![]() OA + ADP +Pi
OA + ADP +Pi
Aceasta enzima sesizeaza scaderea nivelului intermediarilor ciclului citric, pentru ca ea are drept activator acetil-CoA. O descrestere a vitezei de desfasurare a ciclului cauzata de cantitatea insuficienta de oxalacetat (OA) sau alti intermediari produce acumularea acetil-CoA care, activeaza reîncarcarea ciclului via oxalacetat. Exista si alte reactii anaplerotice producatoare de oxalacetat.
În miocard si muschiul scheletic are loc reactia:
PEP + CO2+ GDP ![]() OA + GTP
OA + GTP
O seric de cai catabolice produc intermediari ai ciclului citric printre care mentionam b-oxidarea acizilor cu numar impar de atomi de carbon si degradarea valinei, izoleucinei si metioninei, care dau nastere propionil-CoA, care în urma a doua reactii ulterioare trece în succinil-CoA. De asemenea fenilalanina, tirozina si aspartatul se degrada dând nastere la fumarat si acetoacetat în cazul Phe si Tyr si respectiv fumarat (vezi capitolele Metabolismul lipidic si respectiv al aminoacizilor).
![]() + CO
+ CO![]() 2 + ATP
2 + ATP ![]() →→ Succinil- CoA + ADP +PI
→→ Succinil- CoA + ADP +PI
Unele microorganisme, plantele si anumite nevertebrate, utilizeaza acetil-CoA atât drept combustibil cât si drept sursa pentru sinteza carbohidratilor. De aceea, la aceste organisme unele enzime ale ciclului citric opereaza în doua moduri: a. functioneaza conform ciclului citric, b. produc secventa: izocitrat→glioxilat; glioxilat+acetil-CoA→malat Aceasta secventa dubleaza transformarea ciclului citric a izocitratului în malat realizând un ciclu "scurt" numit ciclul glioxilic.
|