Coroziunea electrochimica a metalelor
1.Generalitati
Spre deosebire de cazul coroziunii chimice, suprafetele metalelor in contact cu solutiile bune conducatoare de electricitate, se corodeaza electrochimic. Solutiile si metalul sunt strabatute in acest caz de un curent electric propriu, generat de procesele electrochimice desfasurate la limita celor doua faze. Coroziunea electrochimica este atribuita adesea activitatii unor pile galvanice microscopice sau de dimensiuni mai mari ai caror anozi realizeaza distrugerea propriu-zisa pe anumite portiuni ale metalului, in timp ce restul suprafetei functioneaza catodic adica nu se distruge.
Suportul experimental al teoriei pilelor locale consta in influenta pronuntata pe care o exercita asupra vitezei de coroziune a metalelor tehnice, neomogenitatile de orice natura, incluziunile de impuritati metalice. De asemenea viteza d 858c25i e coroziune este influentata de eterogenitati de alta natura ca:
pelicule discontinue de coroziune;
portiuni cu tensiuni interne in metal;
compusi intermetalici.
Reactiile de coroziune electrochimica pot fi clasificate dupa trei tipuri de procese :
1. Coroziune cu degajare de H2 pe suprafata metalului
2Na + 2H2O 2NaOH + H2 1.1
Cd + H2SO4 CdSO4 + H2 1.2
Zn + 2NaOH Na2ZnO2 + H2 1.3
2. Coroziunea cu reducere de O2
2Fe + 2H2O + O2 2FeO2 1.4
3. Coroziune cu reducerea ionilor ferici la ioni ferosi
Fe + Fe2(SO4)3 3FeSO4 1.5
In realitate coroziunea se desfasoara pe suprafata metalului sub forma a doua reactii de electrod simultane de sens contrar si cu viteze egale adica legate intre ele prin transferul aceluiasi numar de electroni, reactii complet independente una fata de alta, numite reactii electrochimice conjugate. Viteza acestor reactii depinde in primul rand de potentialul de electrod.
Reactia anodica (reactia de ionizare sau de oxidare a metalului).
Aceasta reactie se poate scrie in forma generala, fara a tine seama de hidratarea ionilor astfel:
M Mz+ + ze - 1.6
In urma reactiei ionul metalic paraseste reteaua cristalina solida, trecand sub forma de ion hidratat in mediul lichid corosiv, lasand in faza solida cantitatea echivalenta de electroni.
Reactia catodica
O+ + ze - O 1.7
Aceasta reactie consta in reducerea unui agent oxidant capabil sa accepte un numar de z electroni rezultati prin ionizarea atomului de metal.
Viteza procesului global al coroziunii, egala cu viteza procesului anodic si cu viteza procesului catodic poate fi exprimata numeric in g/m2h, metal trecut in solutie.
2. Termodinamica coroziunii electrochimice
Calculul termodinamic al coroziunii electrochimice trebuie sa stabileasca daca intr-un sistem dat metal electrolit (mediu agresiv), coroziunea este sau nu posibila din punct de vedere energetic.
Dupa cum se stie la presiune si temperatura constante sunt posibile termodinamic (deci se pot desfasura de la sine) procesele de coroziune insotite de micsorarea potentialului termodinamic izobar. Cu cat acest potential, la trecerea metalului in stare ionica, este mai negativ, cu atat creste tendinta de corodare a metalului. Aceasta conditie se poate formula cantitativ cu relatia:
Δ![]() < Û Δ
< Û Δ![]() = -z F ET
= -z F ET![]() < 0 2.1
< 0 2.1
Δ![]() = variatia potentialului termodinamic izobar;
= variatia potentialului termodinamic izobar;
z = numarul de electroni ce participa la o reactie elementara;
F = constanta lui Faraday;
ET = forta electromotoare a elementului galvanic in care se realizeaza reversibil reactia anodica si cea catodica a procesului de coroziune.
ET = (jc)ech - (ja)ech 2.2
jc)ech = potentialul de echilibru al reactiei catodice a metalului in solutia data;
ja)ech = potentialul de echilibru al metalului in solutia data;
Δ![]() = -z F [(jc)ech - (ja)ech] < 0 2.3
= -z F [(jc)ech - (ja)ech] < 0 2.3
Pentru a fi posibil procesul din punct de vedere termodinamic este necesar ca:
ja)ech < jc)ech 2.4
Coroziunea electrochimica a metalelor este posibila daca potentialul reversibil al metalului in solutia data (ja)ech este mai electronegativ decat potentialul reversibil al unui agent oxidant din aceeasi solutie (jc)ech. Deci calculul termodinamic se reduce la determinarea si compararea potentialelor de echilibru (ja)ech si (jc)ech. Aceste potentiale se gasesc tabelate. Rezultatul obtinut permite sa se aprecieze numai tendinta de corodare a metalului deoarece termodinamica nu poate furniza date asupra vitezei efective si asupra mecanismului coroziunii. Din punct de vedere practic prezinta interes viteza efectiva de coroziune. Daca procesul de coroziune este posibil dar are loc foarte incet, atunci metalul poate fi considerat rezistent la coroziune.
3. Cinetica coroziunii electrochimice
Metalul corodabil scufundat in mediul agresiv va trece in solutie, corespunzator unei reactii constituite din doua reactii elementare de electrod.
A : Me Mez+ + ze - reactie anodica (de oxidare) 3.1
C : O+ + ze - Oze reactie catodica (de descarcare) 3.2
In timpul coroziunii intr-o solutie suficient de buna conducatoare, pe metal se stabileste spontan un singur potential spontan js, avand valoarea intermediara intre potentialele reversibile ale reactiilor partiale de electrod (ja)ech, (jc)ech. Aceasta deplasare a celor doua potentiale de echilibru (ja)ech, respectiv (jc)ech la potentialul de coroziune js se datoreaza fenomenului de polarizare a proceselor de electrod, fenomen ce se produce instantaneu odata cu stabilirea contactului metal-solutie agresiva. Polarizarea reprezinta deplasarea potentialului de echilibru spre o valoare noua sub actiunea trecerii curentului electric propriu (de coroziune) produs de cele doua reactii electrochimice conjugate de electrod: anodica respectiv catodica.
4. Notiuni generale despre fenomenul polarizarii. Tipuri de polarizatie
In cazul unui electrod metalic reversibil scufundat in solutia sarii sale proprii, in absenta oxigenului pe suprafata sa se stabileste spontan potentialul reversibil jrev. In conditii de echilibru, intre electrod si solutie are loc un schimb permanent de ioni cu viteze egale in ambele sensuri numit densitate de curent de schimb i0.
Daca notam ![]() densitatea de curent
de schimb anodic rezultat prin trecerea cationilor in solutie si cu
densitatea de curent
de schimb anodic rezultat prin trecerea cationilor in solutie si cu ![]() densitatea curentului
de schimb catodic rezultat din trecerea cationilor din solutie pe electrod,
atunci se poate scrie ca i0
=
densitatea curentului
de schimb catodic rezultat din trecerea cationilor din solutie pe electrod,
atunci se poate scrie ca i0
= ![]() =
= ![]()
Conditia acestui echilibru se pastreaza cat timp electrodul este mentinut in solutie fara a trece prin el un curent electric. Daca se trimite curent suplimentar i prin electrod (prin introducerea in circuit a unei surse de curent sau prin legarea electrodului cercetat la alt electrod), potentialul electrodului se deplaseaza la o noua valoare ji ¹ jrev, in functie de densitatea curentului. Diferenta dintre cele doua potentiale se numeste polarizatie si se noteaza cu h
h ji jrev 4.1
Polarizatia este negativa, cand prin electrod se trimite curent catodic ( i<0 ) si are ca efect producerea unor ioni si este pozitiva cand prin electrodul cercetat se trimite un curent anodic ( i>0 ), care are ca efect dizolvarea anodica.
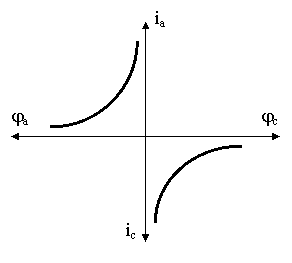 Masurarea
directa a potentialului metal-solutie nu este posibila si de aceea in practica
se procedeaza la masurarea fortei electromotoare a unei pile formate din
electrodul de cercetat si un electrod de referinta. Rezultatul masurarii
potentialului in absenta curentului ( i=0
) si la diferite valori ale acestuia (i1,
i2, in ), permite trasarea curbelor de polarizatie anodica
sau catodica. Alura lor este diferita de la metal la metal .
Masurarea
directa a potentialului metal-solutie nu este posibila si de aceea in practica
se procedeaza la masurarea fortei electromotoare a unei pile formate din
electrodul de cercetat si un electrod de referinta. Rezultatul masurarii
potentialului in absenta curentului ( i=0
) si la diferite valori ale acestuia (i1,
i2, in ), permite trasarea curbelor de polarizatie anodica
sau catodica. Alura lor este diferita de la metal la metal .
Fig. 4.1 Curbele de polarizatie anodica si catodica pentru un metal oarecare. (curbele Pourbaix)
Tipuri de polarizatie
Dupa conceptia moderna asupra proceselor de electrod, cauza polarizarii consta in doua fenomene principale de franare a acestora..
In primul rand trecerea curentului provoaca pe interfata electrod solutie o variatie a concentratiei reactantilor, care in timpul procesului ia o alta valoare decat cea de echilibru, respectiv cea din masa solutiei. In acest caz este vorba despre polarizatia de concentratie notata cu hd
Polarizatia de concentratie poate fi produsa de saracirea sau imbogatirea in ioni a straturilor din vecinatatea electrozilor, ca urmare a vitezei mici de difuzie de la electrod spre solutie in cazul reactiei anodice sau de la solutie spre electrod in cazul reactiei catodice.
Polarizatia de concentratie poate fi micsorata sau indepartata complet prin agitarea solutiei. Aceasta polarizatie se mai numeste si polarizatie de difuzie si se noteaza cu hd
In al doilea rand insasi reactia electrochimica de transfer, adica trecerea ionilor prin limita dintre cele doua faze, necesita o energie suplimentara si prin urmare o crestere a potentialului. In acest caz este vorba de o polarizatie electrochimica he, numita si supratensiune sau polarizatie de transfer.
Cand variatia concentratiei de ioni este urmarea unei viteze mici de desfasurare a unor reactii chimice precedente sau ulterioare reactiei de transfer, polarizatia se numeste de reactie hr
Un ultim tip de polarizatie este polarizatia de pasivare hq. Aceasta se datoreaza aparitiei peliculei de pasivare care incetineste foarte mult procesul de coroziune. In cazul pasivarii curentul anodic ia valori foarte mici chiar daca potentialul anodic jA capata valori mari.
In caz ideal :
h hd he hr hq 4.2
In realitate insa, in unele cazuri apar si diferente.
- cand viteza de difuzie a reactiilor chimice este foarte mare:
hd hr = 0 4.3
- cand he = 0 in cazul electrozilor care au densitatea curentului de schimb foarte mare.
4.4
5 Coroziunea metalului omogen
Practic nu se intalnesc metale omogene datorita prezentei unei cantitati mici de impuritati sau defectelor de structura. Totusi coroziunea metalului omogen intereseaza deoarece furnizeaza elementele necesare pentru intelegerea proceselor mai complexe care se desfasoara pe suprafata structurilor eterogene.
Mecanismul coroziunii metalului pur se studiaza convenabil prin compararea comportarii in mediul acid a unui electrod reversibil de hidrogen si a unui electrod metalic cu potential electronegativ (amalgamul pur de zinc).
Electrodul reversibil de hidrogen se obtine prin saturarea cu hidrogen pur a unei placute de platina sau paladiu, prin scufundare intr-o solutie ce contine ioni de hidrogen (de obicei acid).
Pe electrodul de platina scufundat in solutia saturata in hidrogen a unui acid pot avea loc doua reactii simultane de sens contrar.
De tip A : 1/2H2 H+ + 1e - reactie anodica (de ionizare) 5.1 De tip B : H+ + 1e - 1/2H2 reactie catodica (de descarcare) 5.2
In conditii de echilibru aceste reactii decurg cu viteze egale:
i0 = ![]() =
= ![]() 5.3
5.3
la echilibru i = 0 si ji jrev Þ h 5.4
In aceste conditii compozitia sistemului si potentialul nu variaza in timp. Spre deosebire de electrodul reversibil de hidrogen, pe suprafata amalgamului de zinc in contact cu solutia de hidrogen a unui acid mineral sunt posibile urmatoarele reactii elementare :
Zn Zn2+
+ 2e - reactie anodica (se desfasoara cu
viteza ![]() ) 5.5
) 5.5
Zn2+ + 2e - Zn reactie catodica (se desfasoara cu
viteza ![]() ) 5.6
) 5.6
1/2H2 H+
+ 1e - reactie anodica
(se desfasoara cu viteza ![]() ) 5.7
) 5.7
H+ + 1e - 1/2H2 reactie catodica (se desfasoara cu
viteza![]() ) 5.8
) 5.8
Cele patru reactii electrochimice pot lua parte la doua procese de schimb conform reactiilor:
I. Zn Zn2+ + 2e -
II. 1/2H2 H+ + 1e -
Cat timp metalul se dizolva de la sine cu degajare de hidrogen, viteza efectiva de dizolvare este:
i2 = ![]() -
- ![]() 5.9
5.9
adica diferenta densitatilor de curent a reactiei de ionizare I si a reactiei de descarcare II, va fi egala cu viteza de descarcare a hidrogenului :
i1 = ![]() -
- ![]() 5.10
5.10
Putem atunci spune ca:
i1 = i2 = is 5.11
unde is = curentul stationar de coroziune.
Potentialul ![]() pe care il ia
electrodul in timpul dizolvarii sale cu viteza is se numeste potential stationar. El mai este cunoscut
in literatura de specialitate si sub denumirile de potential mixt, potential
mediu, potential comun sau potential de compromis. Reactiile anodice 5.5. si 5.7 pe de-o parte si reactiile
catodice 5.6 si 5.8 pe de alta parte se numesc reactii electrochimice
conjugate. Ele se desfasoara simultan si independent una de alta si viteza
uneia nu influenteaza viteza celeilalte. Deci la un potential stationar
pe care il ia
electrodul in timpul dizolvarii sale cu viteza is se numeste potential stationar. El mai este cunoscut
in literatura de specialitate si sub denumirile de potential mixt, potential
mediu, potential comun sau potential de compromis. Reactiile anodice 5.5. si 5.7 pe de-o parte si reactiile
catodice 5.6 si 5.8 pe de alta parte se numesc reactii electrochimice
conjugate. Ele se desfasoara simultan si independent una de alta si viteza
uneia nu influenteaza viteza celeilalte. Deci la un potential stationar ![]() se poate scrie ca:
se poate scrie ca:
![]() +
+ ![]() =
= ![]() +
+ ![]() 5.12
5.12
In concluzie, suma vitezelor tuturor reactiilor catodice este egala cu suma vitezelor reactiilor anodice sau astfel spus numarul de electroni eliberati in cursul reactiilor anodice, este egal cu numarul de electroni asimilati in cursul reactiilor catodice.
Metalul pur scufundat intr-o solutie acida sau in alt
electrolit, cu conductibilitate mare ia de la sine un potential stationar ![]() constant in timp,
acelasi pe intreaga suprafata metalica, la care oxidarea metalului si reducerea
oxidantului au loc cu aceeasi viteza
egala cu is. Acestea sunt
deci caracteristicile principale ale starii stationare.
constant in timp,
acelasi pe intreaga suprafata metalica, la care oxidarea metalului si reducerea
oxidantului au loc cu aceeasi viteza
egala cu is. Acestea sunt
deci caracteristicile principale ale starii stationare.
In conditiile coroziunii metalelor tehnice, potentialul stationar variaza de obicei in prima perioada a coroziunii tinzand apoi spre o valoare constanta, care se poate mentine numai daca concentratia ionilor de metal si a oxidantului in solutie sunt constante.
6. Coroziunea metalului eterogen
Mecanismul coroziunii structurilor eterogene este mai complex decat cel al coroziunii metalului omogen. In principiu pe fiecare portiune omogena a unei suprafete eterogene se pot desfasura reactii de electrod in ambele sensuri. In acelasi, timp pe portiuni de natura diferita, pot avea loc reactii de electrod diferite. Coroziunea metalului eterogen se poate studia convenabil urmarind coroziunea in acizi a zincului impurificat cu cupru.(Fig. 6.1)

Fig.6.1
Daca zincul ar fi pur potentialul de coroziune stationar ![]() s-ar stabili la aceeasi valoare cuprinsa intre
s-ar stabili la aceeasi valoare cuprinsa intre ![]() si
si ![]() la care vitezele celor
doua reactii sunt egale. Pe zincul impurificat se stabileste insa un potential
la care vitezele celor
doua reactii sunt egale. Pe zincul impurificat se stabileste insa un potential ![]() . Din cauza reactiei de descarcare a ionilor de hidrogen pe
cupru are loc deplasarea potentialului
. Din cauza reactiei de descarcare a ionilor de hidrogen pe
cupru are loc deplasarea potentialului ![]() la
la ![]() la care viteza de
ionizare a zincului este egala cu suma vitezelor de descarcare a ionilor de
hidrogen pe cupru si zinc.
la care viteza de
ionizare a zincului este egala cu suma vitezelor de descarcare a ionilor de
hidrogen pe cupru si zinc.
Intrucat impuritatile de cupru sunt
in contact direct metalic cu masa de zinc, ele vor trebui sa ia acelasi potential,
ceea ce este posibil numai daca prin incluziunile de cupru va trece un curent
catodic i![]() compensat de un curent anodic
compensat de un curent anodic ![]() de aceeasi marime pe suprafata zincului. Aceasta fractiune de
curent i
de aceeasi marime pe suprafata zincului. Aceasta fractiune de
curent i![]() ce trece de la suprafata de zinc la cea de cupru
se numeste curent local de coroziune si se mai noteaza cu
ce trece de la suprafata de zinc la cea de cupru
se numeste curent local de coroziune si se mai noteaza cu ![]() .
.
ic
= ![]() +
+ ![]() 6.1
6.1
In teoria clasica a coroziunii se admite
ca distrugerea metalului se datoreaza exclusiv curentului local i![]() iar zincul si cuprul erau considerate electrozii
unor elemente galvanice (pile locale scurtcircuitate ). Localizarea coroziunii
are o importanta practica deosebita insa
mecanismul coroziunii nu se reduce numai la functionarea simpla a unei pile
locale, ci trebuie avut in vedere intregul mecanism de formare a potentialului
stationar. Desfasurarea normala a celor doua reactii de electrod nu necesita
diferentierea suprafetei metalice care se corodeaza , in portiuni exclusiv
anodice si catodice. Pe suprafata omogena, ambele reactii se pot produce cu
aceeasi probabilitate in orice punct al suprafetei, cauza coroziunii fiind
micsorarea energiei libere a sistemului si nu existenta unor pile galvanice
locale. In cazul suprafetei eterogene poate sa apara o localizare pronuntata a
reactiilor de electrod, daca incluziunile sunt astfel amplasate incat pe unele
portiuni se poate desfasura mai usor procesul catodic iar pe altele procesul
anodic. Gradul de diferentiere al acestor procese depinde de gradul de
eterogenitate al suprafetei, insa in principiu, in limitele fiecarei portiuni
omogene, se pot desfasura ambele reactii electrochimice conjugate.
iar zincul si cuprul erau considerate electrozii
unor elemente galvanice (pile locale scurtcircuitate ). Localizarea coroziunii
are o importanta practica deosebita insa
mecanismul coroziunii nu se reduce numai la functionarea simpla a unei pile
locale, ci trebuie avut in vedere intregul mecanism de formare a potentialului
stationar. Desfasurarea normala a celor doua reactii de electrod nu necesita
diferentierea suprafetei metalice care se corodeaza , in portiuni exclusiv
anodice si catodice. Pe suprafata omogena, ambele reactii se pot produce cu
aceeasi probabilitate in orice punct al suprafetei, cauza coroziunii fiind
micsorarea energiei libere a sistemului si nu existenta unor pile galvanice
locale. In cazul suprafetei eterogene poate sa apara o localizare pronuntata a
reactiilor de electrod, daca incluziunile sunt astfel amplasate incat pe unele
portiuni se poate desfasura mai usor procesul catodic iar pe altele procesul
anodic. Gradul de diferentiere al acestor procese depinde de gradul de
eterogenitate al suprafetei, insa in principiu, in limitele fiecarei portiuni
omogene, se pot desfasura ambele reactii electrochimice conjugate.
Daca vitezele unora dintre procesele partiale sunt neglijabile poate rezulta practic localizarea totala a proceselor anodic si catodic, distrugandu-se prin coroziune locala doar portiunile ce functioneaza anodic (ex: coroziune intercristalina, coroziune punctiforma pitting ). Repartizarea curentilor locali de coroziune pe suprafata metalului tehnic este atat de complexa incat un calcul exact al lor nu este posibil. Cu toate acestea studiul electrochimic al diversilor constituenti structurali ai metalului eterogen poate furniza date asupra polaritatii lor in timpul coroziunii.
7. Coroziunea a doua metale in contact
In conditii practice contactul a doua metale, chiar de inalta puritate, trebuie considerat ca un sistem in care sunt posibile cel putin patru reactii de electrod. Cele patru reactii posibile intr-un sistem de doua metale introduse in solutie corosiva sunt:
Ionizarea metalului M1:
M1 M1z+ + ze - 7.1
Ionizarea metalului M2:
M2 M2z+ + ze - 7.2
Degajarea hidrogenului pe metalul M1:
1/2H2 H+ + 1e - 7.3
Degajarea hidrogenului pe metalul M2:
1/2H2 H+ + 1e - 7.4
Daca metalele M1
si M2 nu s-ar afla in contact atunci M1 s-ar coroda cu
viteza ia1 la potentialul ![]() iar M2 s-ar coroda cu viteza ia2 la potentialul
iar M2 s-ar coroda cu viteza ia2 la potentialul
![]() . Din cauza contactului metalic cele doua potentiale
stationare
. Din cauza contactului metalic cele doua potentiale
stationare ![]() si
si ![]() se egaleaza la
valoarea
se egaleaza la
valoarea ![]() la care viteza de
coroziune a metalului M2 scade cu Dia2
iar viteza de coroziune a
metalului M1 creste cu Dia1. De aici apare explicatia protectiei
anticorosive prin metode electrochimice.
la care viteza de
coroziune a metalului M2 scade cu Dia2
iar viteza de coroziune a
metalului M1 creste cu Dia1. De aici apare explicatia protectiei
anticorosive prin metode electrochimice.
Aceste metode sunt:
- metoda anozilor sacrificati
- protectia catodica folosind curenti exteriori
Metoda anozilor sacrificati
Daca in locul metalului M1 s-ar fi luat un alt metal cu potential
reversibil mai electronegativ decat ![]() , potentialul
, potentialul ![]() al contactului ar fi
rezultat de asemenea mai negativ. In practica se alege un metal M1
atat de electronegativ incat la contact acesta se dizolva protejand partial sau
integral metalul M2. Deci metoda anodului sacrificat consta in
fixarea pe obiectul protejat a unor placi de Zn, Mg sau Al, cu potential
puternic electronegativ.
al contactului ar fi
rezultat de asemenea mai negativ. In practica se alege un metal M1
atat de electronegativ incat la contact acesta se dizolva protejand partial sau
integral metalul M2. Deci metoda anodului sacrificat consta in
fixarea pe obiectul protejat a unor placi de Zn, Mg sau Al, cu potential
puternic electronegativ.
Metoda protectiei catodice cu curenti exteriori
Aceasta consta in conectarea piesei de protejat la polul negativ al unei surse de curent la al carei pol pozitiv este legat un anod indiferent (otel, grafit, etc).
8. Coroziunea mai multor metale in contact
Coroziunea mai multor metale in
contact apare in cazul unor instalatii industriale ce au in componenta otel,
bronzuri, alame, Zn, Al, instalatii ce se afla in contact cu solutii de
electroliti. Akimov a denumit astfel de constructii sisteme de polielectrozi,
ce dau nastere unor macropile galvanice de coroziune. In solutii suficient de
bune conducatoare de electricitate (polare), sistemele polimetalice pot fi
considerate ca pile polielectrodice scurtcircuitate. In acest caz se pune
problema determinarii unui potential de compromis, notat ![]() , al tuturor metalelor in contact, dupa care se stabileste
care metale lucreaza ca anozi si care functioneaza drept catozi. Acele metale
care au potentialul reversibil mai electronegativ decat
, al tuturor metalelor in contact, dupa care se stabileste
care metale lucreaza ca anozi si care functioneaza drept catozi. Acele metale
care au potentialul reversibil mai electronegativ decat ![]() vor functiona ca anozi
si se vor distruge, iar cele cu potential reversibil mai electropozitiv decat
vor functiona ca anozi
si se vor distruge, iar cele cu potential reversibil mai electropozitiv decat ![]() , functionand catodic, raman protejate.
, functionand catodic, raman protejate.
9. Influenta diferitilor factori asupra coroziunii electrochimice
1. Natura metalului
Coroziunea unui metal este posibila daca potentialul sau reversibil este mai negativ decat potentialul reversibil al unui agent oxidant in aceeasi solutie. Luand ca baza seria potentialelor standard de electrod, se poate considera ca in apa cu sau fara continut de saruri neutre tind sa se corodeze toate metalele care au potentiale reversibile mai negative decat 0,414 V si anume: metale alcaline, metale alcalino-pamantoase, Al, Ti, Zr, Cr, Zn, Fe. In practica insa numai metalele alcaline si alcalino-pamantoase descompun apa, celelalte trecand in stare pasiva in apa si chiar in unii acizi oxidanti. Rezulta ca nu exista un paralelism riguros intre locul metalelor in seria potentialelor standard si in sistemul periodic pe de-o parte si comportarea lor la coroziune pe de alta parte. Totusi exista o concordanta cu caracter general intre stabilitatea metalelor la coroziune si locul acestora in cele doua sisteme. Astfel metalele cu cele mai electronegative potentiale standard au si stabilitatea chimica cea mai mica, respectiv rezistenta la coroziune mica. Este vorba de Li, Na, K, Pb, Cs.
Rezistenta anticorosiva a metalelor in subgrupele din dreapta si in grupa a opta secundara a sistemului periodic, creste de sus in jos ca in subgrupele:
Cu Zn Fe
Ag Cd Rb
Au Hg Os
Metalele cu cea mai mare tendinta de pasivare se afla in randurile de jos, pare ale perioadelor mari, in grupele 4, 5, 6, 7, 8, secundare.
2. Structura si starea suprafetei metalului
Cele mai stabile aliaje la coroziune sunt cele de tip solutie solida deoarece acestea sunt constituenti omogeni (monofazic, Fa la temperatura ambianta). Diferiti constituenti cu structura eterogena (amestecuri mecanice, compusi chimici), intensifica procesul de coroziune pentru ca se afla in contact cu matricea si aliajul se comporta ca doua metale aflate in contact in acelasi mediu corosiv. Exceptie face, de exemplu, eutecticul Al-Si din siluminuri carte rezista bine la coroziune in apa de mare.
Cercetand comportarea anticorosiva a solutiilor solide, Tamann a stabilit o regula de mare importanta practica, numita regula limitei de rezistenta chimica sau regula n/8 (n este numar intreg ce ia valorile 1, 2, 4, 6 ). Conform acestei reguli rezistenta la coroziune a aliajelor tip solutie solida creste brusc cu variatia compozitiei, in momentul in care continutul elementului stabil fata de cel al elementului instabil intr-un mediu dat atinge fractiunea n/8
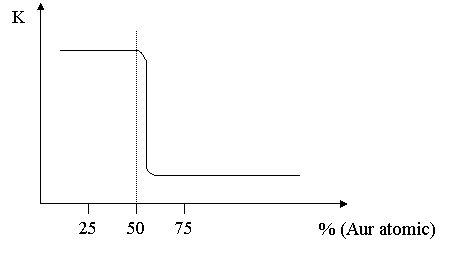
Fig. 9.1
Intr-o solutie de Cu-Au scufundata in acid azotic (HNO3) rezistenta la coroziune creste brusc la peste 50% Au atomic. Pana la 50% Au atomic solutia se corodeaza cu viteza de coroziune a cuprului. La o mica depasire a procentului de Au atomic, viteza de coroziune K scade pana la valori foarte mici. Deci creste rezistenta la coroziune si aliajul are comportarea aurului pur.
Explicatia consta in efectul de ecranare al metalului mai nobil, respectiv aurul din solutia solida, care nu se dizolva din primele momente ale coroziunii, ramanand la suprafata. Distantele interatomice ale metalului nobil sunt mai mici decat diametrul ionilor din mediul corosiv si astfel nu este permisa difuzia acestora spre metal.
Un alt fenomen caracteristic solutiilor solide este dizolvarea selectiva a unuia dintre componenti insotita de distrugerea aliajului.
In cazul alamelor scufundate in solutii acide sau apa de mare are loc un fenomen de dizolvare a zincului, mai exact de trecere a zincului in solutie astfel incat in metal ramane numai cuprul sub forma de pulbere fina. Consecinta procesului de dezincare este pierderea coeziunii aliajului si deci reducerea drastica a proprietatilor mecanice.
Marimea grauntilor cristalini
Aceasta influenteaza in mica masura coroziunea, insa viteza de coroziune creste cu gradul de dispersie a impuritatilor deci cu finetea structurii, cu conditia ca aceste impuritati sa functioneze catodic.
Comportarea aliajelor ce constau din doua faze diferite depinde de polaritatea celor doi constituenti. Daca metalul de baza functioneaza preponderent ca anod si nu are tendinta de pasivare iar componentul structural are rol de anod, rezulta intensificarea coroziunii in raport cu cea a metalului de baza in stare pura.
Tensiunile interne si deformatiile intensifica coroziunea in toate cazurile si adesea inrautatesc repartitia ei transformand-o dintr-o coroziune uniforma intr-o coroziune locala sau intercristalina.
4. Starea suprafetei metalului
Aceasta influenteaza asupra coroziunii electrochimice, deoarece o suprafata rugoasa este mai expusa la coroziune decat una neteda. Raportul dintre suprafata efectiva si cea teoretica este :
![]() = 6 pentru piese brut turnate ;
= 6 pentru piese brut turnate ;
![]() = 1,2 pentru piese rectificate, lustruite.
= 1,2 pentru piese rectificate, lustruite.
Influenta calitatii suprafetei se resimte mai ales in conditiile coroziunii atmosferice cand rolul principal in coroziune il are condensarea umezelii in capilarele fine ale asperitatilor superficiale.
5. Compozitia solutiei corosive
Principalele caracteristici ale solutiei care prezinta interes din punct de vedere al coroziunii sunt: aciditatea solutiei (pH-ul), continutul de oxigen, concentratia sarurilor in solutie, prezenta acceleratorilor sau inhibitorilor de coroziune.
- Influenta oxigenului din solutie Oxigenul poate avea dublu rol si anume :
Un rol de accelerator de coroziune (accelerator catodic), adica rol de agent oxidant care se reduce relativ usor pe metale facand posibila si chiar accelerand coroziunea. La probele imersate in solutii corosive intensitatea coroziunii este mai mare la interfata lichid atmosfera. De asemenea agitarea mediului corosiv datorita curgerii libere sau fortate maresc aportul de oxigen in solutie si intensifica coroziunea.
Un al doilea rol este acela de inhibitor de coroziune (franarea procesului anodic) atunci cand concentratia lui in solutie este asa de mare incat creste stabilitatea peliculelor protectoare pasivante pe suprafata metalului.
- Influenta concentratiei sarurilor in solutie
Concentratia sarurilor in solutie influenteaza diferit coroziunea:

Fig.9.2 Influenta continutului de sare din solutie asupra vitezei de coroziune a otelului moale scufundat la 35oC
La un continut mic
de sare viteza de coroziune creste cu concentratia sarii, ca rezultat al
cresterii continutului de anioni ![]() care activeaza
procesul anodic.
care activeaza
procesul anodic.
Efectul contrar, de scadere a vitezei de coroziune inregistrat in domeniul urmator (dupa 0,75) se datoreaza micsorarii solubilitatii oxigenului cu cresterea concentratiei sarii in apa.
- Influenta pH-ului este importanta
deoarece pe masura cresterii aciditatii solutiei valorile potentialelor
reversibile ![]() si
si ![]() devin din ce in ce mai
pozitive si viteza coroziunii creste.
devin din ce in ce mai
pozitive si viteza coroziunii creste.
Acizii cu functie oxidanta HNO3 H2SO4 concentrati exercita o actiune mai complexa asupra metalelor deoarece se formeaza cu o pelicula protectoare rezistenta la acid, care face imposibila studierea influentei directe a pH-ului asupra vitezei de coroziune. Variatia pH-ului solutiei are si o influenta indirecta asupra coroziunii, in functie de variatia solubilitatii si a proprietatilor protectoare ale produselor de coroziune cu pH-ul mediului. Din acest punct de vedere metalele tehnice se impart in doua grupe:
1. metale ale caror oxizi au proprietati amfotere : Al, Zn, Sn, Pb, care se corodeaza atat in acizi cat si in alcalii.
2. metale care dau oxizi solubili in acizi dar insolubili in alcalii : Fe, Ni, Cu, Cd, Mg.

Fig 9.3 Variatia vitezei de coroziune cu pH-ul.
a. metale din prima categorie; b. metale din a doua categorie
- Prezenta acceleratorilor sau inhibitorilor de coroziune influenteaza direct viteza de coroziune chiar daca acestia sunt in cantitati mici sau foarte mici.
Importanta practica pentru coroziune prezinta inhibitorii de coroziune, insa trebuie cunoscute si proprietatile electrochimice ale acceleratorilor de coroziune.
Dupa procesul de electrod asupra caruia exercita actiunea principala, inhibitorii anorganici se impart in inhibitori anodici si catodici. Inhibitorii organici se folosesc in general la combaterea coroziunii in medii acide iar atunci cand au tensiunea de vapori suficient de mare se folosesc in calitate de inhibitori volatili.
Dintre inhibitorii anodici mai importanti sunt :
- bicromatul de potasiu (K2O2Cr7) 0,1 0,01% - reducerea coroziunii Fe si Al.
- azotitul de sodiu (NaNO2) conservarea sculelor instrumentelor si pieselor.
- azotatul de sodiu (NaNO3) pentru cazanele de abur.
Acesti inhibitori se folosesc in solutii de H2O neutra, putin activa anodic (fara anioni de Cl, Br, I), pentru ca altfel predomina viteza de reducere a lor fata de viteza actiunii pasivante. Unii inhibitori anorganici sunt considerati inhibitori anodici, deoarece formeaza cu ionii metalici trecuti in solutie produse de coroziune insolubile, care se depun pe metal sub forma unor pelicule protectoare aderente. Aceste produse (hidroxid de sodiu (NaOH), carbonat de sodiu (NaCO3), fosfat acid de sodiu (NaHPO4), silicat de sodiu (Na4Si)), realizeaza o ecranare a metalului si reduc suprafata de contact intre metal si mediul agresiv.
Inhibitorii catodici anorganici sulfitul de sodiu (Na2SO3) si hidrazina (NH2NH2) micsoreaza sau chiar impiedica procesul catodic deoarece consuma oxigenul dizolvat in apa, trecand in produse inofensive.
Na2SO4 Na2SO3 9.1
NH2 - NH2 N2 +H2O 9.2
Actiunile inhibitoare ale carbonatului acid de calcar (Ca(CO3)2), sulfatului de zinc, clorurii de zinc(ZnCl2), pot fi atribuite alcalinizarii mediului ceea ce atrage dupa sine precipitarea carbonatului de calciu sau a dioxidului de zinc protectoare pentru metal. Astfel se explica agresivitatea mai redusa a apelor naturale (dure), bogate in carbonati fata de cea a apelor moi.
Coroziunea in mediul acid poate fi inhibata de sarurile unor metale electropozitive cu supratensiune relativ mare de hidrogen.(Ex: AsCl3, Bi2(So4)3). Dezlocuind aceste metale din solutia acida a sarurilor lor, ferul se acopera cu un strat fin de arseniu respectiv bismut, cu o supratensiune de hidrogen mai mare decat supratensiunea hidrogenului pe fer. Acceleratorii de coroziune intensifica distrugerea metalelor, atunci cand sunt adaugati intr-un mediu agresiv oarecare.
In practica sunt considerati drept acceleratori de coroziune, anionii de halogeni, agentii de complexare care, inglobeaza in timpul coroziunii ionii de metal proaspat formati, in complecsi solubili putin disociati, mentinand o concentratie redusa de ioni in solutie si deci viteze mai mari de ionizare a metalului decat in absenta lor.
6. Influenta temperaturii asupra coroziunii electrochimice

Fig.9.4 Variatia vitezei de coroziune cu temperatura
In cazul solutiilor acide variatia de temperatura exercita o influenta puternica asupra coroziunii electrochimice, exprimata cantitativ de relatia lui Arrhenius.

K = constanta vitezei coroziunii chimice;
![]() ,Q = constante ce pot fi calculate pe baza
determinarii experimentale a vitezei de coroziune a vitezei K la cel putin doua
temperaturi diferite T1 si T2 .
,Q = constante ce pot fi calculate pe baza
determinarii experimentale a vitezei de coroziune a vitezei K la cel putin doua
temperaturi diferite T1 si T2 .
Variatiile de temperatura pot influenta si indirect coroziunea de exemplu, prin intermediul influentei pe care o exercita asupra pH-ului solutiei. Astfel solutiile cu reactie neutra la rece dau reactie acida la cresterea temperaturii. De asemenea comportarea la coroziune a diverselor metale depinde in mare masura si de variatia proprietatilor peliculelor protectoare cu temperatura. De exemplu, pe zinc sub 50 oC se depune o pelicula aderenta sub forma de gel care este foarte protectoare; in schimb intre 50 oC si 95 oC se formeaza un produs cu aspect grauntos care rezista mai putin la coroziune.
7. Influenta presiunii solutiei asupra coroziunii
Sub actiunea presiunii apar tensiuni puternice in metal, se ingreuneaza imbinarea si etansarea detaliilor de constructie si totodata creste solubilitatea gazelor in solutie. Influenta cresterii presiunii se resimte mai intens in cazul in care oxidantul este un gaz dizolvat in solutie. Accelerarea coroziunii datorita cresterii presiunii se manifesta mai intens in cadrul proceselor ce se desfasoara la temperaturi inalte.
8. Influenta vitezei de curgere a solutiei
Intensificarea coroziunii ferului in medii neutre cu accelerarea curgerii la o viteza relativ mica se datoreaza intensificarii aportului de oxigen la suprafata metalica. In conditiile unui aport intens de oxigen coroziunea se poate atenua di cauza pasivarii treptate a ferului. La viteze mari jeturile de lichid tind sa smulga particulele din pelicula de protectie, iar metalul descoperit, venind in contact cu cantitati marite de oxidant se corodeaza mai intens.(Ex: corodarea tevilor de alama din condensatoare, corodarea rotoarelor, corodarea unor agitatori de suspensii ce contin particule dure ).
La viteze foarte mari de curgere in masa solutiei pot aparea bule, cu depresiuni puternice dand efecte de izbire si extragere cand se distrug nu numai peliculele ci si metalul insusi. Acest fenomen este cunoscut sub denumirea de cavitatie.
9. Influenta timpului asupra proceselor de coroziune
Evolutia coroziunii electrochimice in timp prezinta interes practic. Pe baza datelor experimentale pot fi construite doua tipuri de curbe:
a. curbe pierdere de greutate timp sau y = f (t)
b. curbe viteza
de coroziune timp sau ![]() = f (t)
= f (t)
I.
Pentru procesele in care conditiile initiale de coroziune nu variaza in timp (Ex: compozitia solutiei este constanta), iar produsele de coroziune nu au proprietati protectoare, avem o variatie liniara a pierderilor de masa in timp.

Fig. 9.5
II.
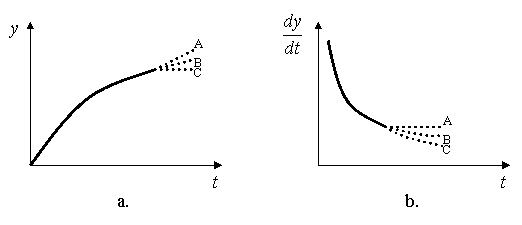 Pentru procesele in care coroziunea se
atenueaza cu timpul din cauza formarii peliculelor din ce in ce mai
protectoare.
Pentru procesele in care coroziunea se
atenueaza cu timpul din cauza formarii peliculelor din ce in ce mai
protectoare.
Fig. 9.6
In acest caz viteza
de coroziune ![]() variaza dupa o curba
descendenta a carei portiune terminala devine paralela cu abscisa (cazul B), o
intersecteaza (cazul C) sau scade lent (cazul A), dupa cum curba y = f (t) se
termina intr-o dreapta B, o orizontala C sau o portiune usor ascendenta A.
variaza dupa o curba
descendenta a carei portiune terminala devine paralela cu abscisa (cazul B), o
intersecteaza (cazul C) sau scade lent (cazul A), dupa cum curba y = f (t) se
termina intr-o dreapta B, o orizontala C sau o portiune usor ascendenta A.
III.
Pentru coroziunea metalelor in acizi si a aluminiului in alcalii.
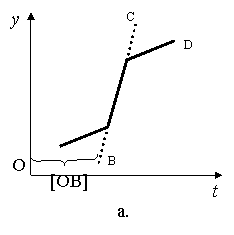

Fig. 9.7
In acest caz coroziunea se intensifica cu timpul fie din primul moment al contactului, fie dupa un anumit timp [OB], de la scufundarea probei in mediul coroziv. Intensificarea procesului poate fi datorata distrugerii peliculei protectoare sau cresterii temperaturii. Dupa un timp se stabileste un regim stationar C cand coroziunea este constanta in timp.
10. Pasivitatea metalelor
Pasivitatea reprezinta o stare de rezistenta mare la coroziune a metalelor si aliajelor, in conditiile in care, din punct de vedere termodinamic, aceste metale sunt active (deci se pot coroda), rezistenta provocata de micsorarea procesului anodic sub actiunea deplasarii in sens pozitiv a potentialului.
Ferul si numeroase alte metale tehnice se dizolva in HNO3 diluat iar viteza de dizolvare creste cu concentratia acidului. In cazul nparticular al ferului exista o concentratie critica a acidului la care viteza dizolvarii scade brusc si peste care coroziunea devine practic neglijabila desii nu inceteaza cu desavarsire.
Faraday a emis ipoteza ca starea pasiva a ferului se datoreaza formarii unor compusi intre atomii de metal de la suprafata si oxigen.
Starea pasiva a metalelor poate fi clasificata dupa metoda prin care a fost provocata sau dupa aspectul suprafetei rezultate in urma procesului, in urmatoarele categorii :
- Pasivitate mecanica atunci cand prin scufundarea metalului in mediul corosiv, la suprafata lui se formeaza straturi groase de compusi chimici, ce au efect protector prin simpla izolare mecanica a fazelor. (Pb scufundat in H2SO4 formeaza la suprafata o pelicula de PbSO4).
- Pasiuvitatea chimica atunci cand metalul scufundat in mediul coroziv se acopera cu un strat fin protector si invizibil (pasivarea ferului in HNO3 concentrat).
- Pasivitatea electrochimica (anodica) atunci cand metalul trece in stare pasiva sub influenta curentului electric exterior
Aceasta clasificare a pasivitatii este conventionala deoarece in toate cazurile mecanismul de pasivare este electrochimic.
In stare activa, metalul simplu introdus in solutie si nelegat la un circuit electric exterior sau anodul metalic, trec in solutie cu formare de ioni hidratati cu conditia ca potentialul lor sa fie suficient deplasat in sens pozitiv de la valoarea potentialului reversibil. Daca potentialul stationar al unui asemenea metal simplu sau potentialul anodului unui circuit este si mai mult deplasat in sens pozitiv, sub actiunea unui factor oarecare, metalul poate ajunge in stare pasiva, cand trecerea ionilor metalici in solutie este impiedicata sau puternic franata de o asanumita bariera de oxigen (strat de compus Me-O2) aflat la suprafata metalului. In prezenta barierei protectoare de oxigen viteza de coroziune a mai multor metale se reduce de sute si mii de ori devenind neglijabila, desi din punct de vedere termodinamic metalul ramane activ.
11. Mecanismul pasivarii
Formarea peliculelor de pasivare
atat la simpla scufundare a metalului in solutia pasivanta, cat si la
functionarea lor in calitate de anozi este rezultatul unor procese
electrochimice, deci starea suprafetelor metalice si viteza proceselor ce se
desfasoara la suprafata sunt determinate de potentialul de electrod. Pentru a
intelege mecanismul pasivarii trebuie sa se studieze curbele ![]() sau asanumitele curbe de polarizatie.
sau asanumitele curbe de polarizatie.

Fig. 11.1 curba de polarizatie
![]() = potentialul electrodului cercetat;
= potentialul electrodului cercetat;
ia = densitatea de curent rezultata in circuitul exterior
La scufundarea electrodului in
solutie, in absenta unui curent in circuitul exterior (ia = 0 ), se stabileste spontan potentialul
stationar ![]()
![]() ¹ 0). In aceasta stare electrodul se corodeaza cu o
viteza icor ¹ 0, care se poate determina pe baza
pierderilor de masa. Deplasarea potentialului in sens pozitiv duce la
intensificarea dizolvarii si la aparitia in circuitul exterior a unui curent a
carui valoare i1, i2, este data de ordonata punctelor
corespunzatoare potentialelor
¹ 0). In aceasta stare electrodul se corodeaza cu o
viteza icor ¹ 0, care se poate determina pe baza
pierderilor de masa. Deplasarea potentialului in sens pozitiv duce la
intensificarea dizolvarii si la aparitia in circuitul exterior a unui curent a
carui valoare i1, i2, este data de ordonata punctelor
corespunzatoare potentialelor ![]() ,
, ![]() .
.
Intensificarea dizolvarii sub
actiunea deplasarilor urmatoare de potential continua pana cand electrodul
atinge potentialul ![]() caruia ii corespunde
curentul ip . La aceasta
valoare o noua deplasare a potentialului la
caruia ii corespunde
curentul ip . La aceasta
valoare o noua deplasare a potentialului la ![]() are ca efect o scadere
brusca a curentului anodic, a vitezei de dizolvare pana la valoarea ik si trecerea metalului in
stare pasiva. Noua valoare a curentului ik
poate fi de zeci de mii de ori mai mica decat valoarea initiala a curentului icor .
are ca efect o scadere
brusca a curentului anodic, a vitezei de dizolvare pana la valoarea ik si trecerea metalului in
stare pasiva. Noua valoare a curentului ik
poate fi de zeci de mii de ori mai mica decat valoarea initiala a curentului icor . ![]() se numeste potential critic de pasivare, iar ip se numeste densitate
critica de curent de pasivare. Deci la valori mai mari ale lui
se numeste potential critic de pasivare, iar ip se numeste densitate
critica de curent de pasivare. Deci la valori mai mari ale lui ![]() curentul de coroziune scade la ik , de valori foarte mici diferite de 0, care arata ca
procesul de coroziune nu a incetat ramanand in continuare posibil din punct de
vedere termodinamic, insa are loc cu viteze extrem de mici, practic
neglijabile. Deci la potentiale mai mari decat
curentul de coroziune scade la ik , de valori foarte mici diferite de 0, care arata ca
procesul de coroziune nu a incetat ramanand in continuare posibil din punct de
vedere termodinamic, insa are loc cu viteze extrem de mici, practic
neglijabile. Deci la potentiale mai mari decat ![]() are loc desavarsirea peliculei de pasivare, iar la valori mai
mici decat
are loc desavarsirea peliculei de pasivare, iar la valori mai
mici decat ![]() metalul se afla in stare activa.
metalul se afla in stare activa.
Starea pasiva se mentine pana la
atingerea potentialului reversibil ![]() la care incepe
separarea gazului. Peste potentialul
la care incepe
separarea gazului. Peste potentialul ![]() intensitatea
curentului creste, dar aceasta crestere nu mai poate fi folosita ca masura
directa a coroziunii, deoarece se datoreaza in mare masura descarcarii ionilor
hidroxil (OH).
intensitatea
curentului creste, dar aceasta crestere nu mai poate fi folosita ca masura
directa a coroziunii, deoarece se datoreaza in mare masura descarcarii ionilor
hidroxil (OH).
Cel mai usor se4 pasiveaza Cr, Mo, Al, Fe, Co, Ni, Ti, Ta, insa variind compozitia solutiei sau densitatea anodica de curent se pot crea conditii in care orice metal trece mai mult sau mai putin in stare de pasivitate.
Prin alierea unui metal mai greu pasivabil cu un component mai usor pasivabil, se pot obtine aliaje usor pasivabile cu structura, in general, de tip solutie solida (Ex: oteluri inoxidabile aliate cu Cr, fonte silicioase). Unele metale ca Al, Cr, Ti, Ta, se pasiveaza usor de la sine prin simplu contact cu oxigenul din aer si raman in stare pasiva atata timp cat pelicula superficiala nu este deteriorata sub actiunea unor factori externi.
Alte metale mai greu pasivabile trec in stare pasiva numai in contact cu medii puternic oxidante : acid azotic (HNO3), azotat de argint (AgNO3), clorat de potasiu (KClO3), bicromat de potasiu (K2Cr2O7), permanganat de potasiu (KMnO4).
Starea pasiva poate aparea brusc sau treptat. In ultimul caz metalul poate trece prin faze intermediare stabile. (Ex: Fe in HNO3 de o anumita concentratie se pasiveaza brusc in timp ce in solutii de cromati viteza de coroziune scade treptat).
Exista un numar de factori care impiedica aparitia pasivitatii sau distrug peliculele pasivante readucand metalele in stare activa. Pasivitatea dispare cand metalele vin in contact cu solutii care dizolva peliculele (Ex: solutii alcaline pe Al si Zn). De asemenea pasivitatea dispare si sub actiunea unor factori mecanici (eroziune, frecare, zgariere) daca viteza de restabilire a starii pasive in mediul dat este mai mica decat viteza de distrugere a peliculei.
Cercetarile experimentale privind pasivitatea metalelor nu au putut duce la o concluzie unica referitor la natura barierei de oxigen din cauza complexitatii fenomenului. De aceea in prezent exista doua teorii ale pasivitatii metalelor.
- teoria peliculei de faza
- teoria peliculei de adsorbtie
Teoria peliculei de faza sustine ca bariera de oxigen care determina starea pasiva a metalului este constituita dintr-o pelicula de faza din oxizi metalici. In prezent pelicula este considerata perfect continua iar compozitia oxidului rezistent in mediul acid si in mediul bazic este aceeasi. Se admite ca procesul electrochimic de dizolvare este inlocuit, in domeniul pasivitatii, prin dizolvarea chimica a peliculei de oxid cu formare de ioni ferici. De asemenea se admite ca pelicula este complet lipsita de pori deoarece, in caz contrar, viteza de dizolvare in pori ar depinde de potential .
Teoria peliculei de adsorbtie considera ca valenta atomilor de metal de la suprafata se satureaza prin formarea de legaturi chimice cu particulele care se pot adsorbi, ceea ce nu duce insa la distrugerea retelei metalice si la formarea unui compus stoechiometric cu retea proprie. Chiar daca acesti compusi s-ar forma cu timpul, ei au numai rolul de a constituii o bariera suplimentara de difuziune.
Conform acestor teorii metalele se impart in trei grupe:
- Metale nobile ce nu formeaza pelicule de faza.
- Metale din grupa ferului pe care autorii teoriei considera ca nu se formeaza pelicule de faza.
- Metale ca Al, Ti, Ta, pe care se formeaza Pelicule groase vizibile de oxizi, lipsite de conductibilitate electronica.
Teoria peliculei de faza se refera numai la primele doua tipuri, aratand ca natura electrochimica a dizolvarii se pastreaza si in conditiile starii pasive in care se schimba numai cinetica procesului anodic.
|