Coroziunea electrochimica
Consideratii teoretice
Spre deosebire de coroziunea chimica,
metalele in contact cu solutiile bune conducatoare de electricitate
(electroliti) se corodeaza electrochimic. Coroziunea electrochimica este un
efect al actiunii pilelor galvanice care se formeaza in diferite moduri. In
orice caz, componentul esential al acestor pile este solutia de electrolit.
Solutia si metalul sunt strabatute, in acest caz, de un curent electric,
generat de procesele electrochimice care se desfasoara la limita celor doua
faze.
Pentru aparitia acestui tip de coroziune este neces 535h74f ar sa existe un anod, un catod, un electrolit si un conductor, deci un element galvanic. Prin inlaturarea uneia dintre aceste conditii, coroziunea electrochimica nu se produce. Dupa cum in practica industriala metalele folosite in mod curent sunt eterogene, se pot considera ca fiind alcatuite din electrozi electrici scurtcircuitati prin insusi corpul metalului respectiv.
Prin introducerea metalului in apa sau in mediul cu proprietati electrolitice, pe suprafata metalului apar elemente galvanice in care impuritatile din metal functioneaza ca microcatozi cu descarcare de hidrogen pe suprafata lor, in timp ce metalul, functionand ca anod se dizolva.
 Exemple tipice de coroziune electrochimica
se intalnesc in cazul coroziunii atmosferice (ruginirea fierului) si la
coroziunea provocata de curentii electrici de dispersie din sol numiti si
curenti vagabonzi.
Exemple tipice de coroziune electrochimica
se intalnesc in cazul coroziunii atmosferice (ruginirea fierului) si la
coroziunea provocata de curentii electrici de dispersie din sol numiti si
curenti vagabonzi.
Fig. 1 Exemple tipice de coroziune electrochimica
Pile cu actiune coroziva pot fi impartite in:
1) pile formate in urma contactului a doua metale diferite (coroziunea galvanica);
2) pile formate in urma contactului metalului cu incluziuni nemetalice, de exemplu oxizi, sulfuri, fosfuri, etc. Aceste incluziuni sunt dispersate in metal. In cazul contactului metalului sau aliajului cu o solutie de electroliti se formeaza numeroase micropile, adica pile locale, a caror actiune constituie cauza coroziunii electrochimice. Efectul daunator al acestor pile depinde in primul rand de forta electromotoare dintre metal si incluziune, de cantitatea si natura incluziunilor, precum si de caracterul produsilor de coroziune;
3) pile formate in urma pasivarii partiale a metalului sau acoperirii lui partiale cu oxizi. Un metal sau un aliaj care a fost supus retopirii sau unui tratament termic sau mecanic contine de obicei pe suprafata lui parti oxidante. Oxizii metalelor au in general potential mai ridicat decat metalele din care s-au format. De aceea, contactul metalului cu oxidul in prezenta unei solutii de electrolit duce la formarea pilelor, in care metalul constituie anodul si se corodeaza;
4) pile formate ca rezultat al tensiunilor mecanice care apar intr-un metal sau aliaj omogen din punct de vedere chimic. Potentialul unui metal sau aliaj trebuie sa fie omogen pe intreaga suprafata. Daca insa metalul sau aliajul se supune actiunii unor agenti mecanici neomogeni, se produc deformatii, care fac ca potentialul metalului sa scada cu atat mai mult cu cat metalul a fost mai mult deformat. Datorita acestui fapt, intre metalul nedeformat si cel deformat apar diferente de potential, care in prezenta solutiilor de electroliti, duc la coroziune electrochimica;
5) pile de concentratie, care se formeaza atunci cand o bucata de metal sau aliaj vine in contact cu solutii de diferite concentratii de saruri sau care contin cantitati diferite de oxigen dizolvat. Aceste pile mai pot aparea si ca efect al diferentelor de temperatura pe suprafata metalului.
Reprezentarea schematica a coroziunii electrochimice in atmosfera umeda este prezentata in figura 4.6.2:
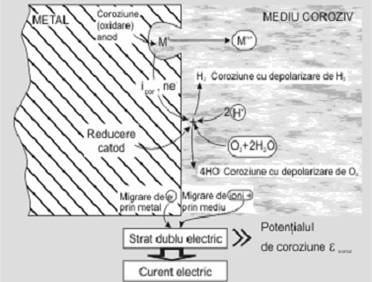
Fig. 4.6.2 Schema coroziunii electrochimice in atmosfera umeda
Sistemul electrochimic de coroziune, metal (aliaj) - mediu coroziv, duce la formarea unui strat dublu electric, asimilat cu un condensator, unde se stabileste o diferenta de potential intre suprafata metalului care s-a incarcat negativ (ne‾) si cea a mediului care devine pozitiva (datorita ionilor de M+ rezultati din coroziune). Aceasta diferenta de potential este potentialul unic la care se produce coroziunea si se numeste potential de coroziune, ecoroz sau potential mixt. Potentialul de coroziune, ecoroz al unui metal sau aliaj difera de potentialul de echilibru, eM al metalului sau aliajului.
Coroziunea implica doua reactii simultane cu schimb de ioni si electroni intre metal si mediu si ca urmare a acestui schimb, in timpul coroziunii pe metal (aliaj) apare potentialul ecoroz, a carui valoare se stabileste prin deplasarea unuia spre celalalt a potentialelor de echilibru a metalului, eM si mediului, eD (D este depolarizantul din mediu).
Deplasarea celor doua potentiale de echilibru, la potentialul de coroziune este o consecinta a fenomenelor de polarizare anodica ( a si catodica ( c) a proceselor de electrod, fenomen ce apare instantaneu la contactul metal - mediu.
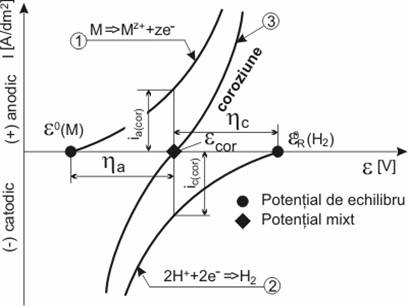
Fig. 4.6.2. Deplasarea potentialelor de echilibru
In problemele practice de coroziune importanta este cunoasterea vitezelor reale cu care procesul se desfasoara. Daca procesul de coroziune este posibil, dar are o viteza de desfasurare foarte mica, se poate considera ca materialul este rezistent la coroziune. Viteza de coroziune se exprima prin masa de metal distrus pe unitatea de suprafata in unitatea de timp, [g/m2h] sau adancimea la care au ajuns degradarile in unitatea de timp, [mm/an].
Cunoasterea acestor indici permite alegerea corespunzatoare a materialului in functie de natura mediului, ceea ce determina o dimensionare corespunzatoare a instalatiilor si o justa apreciere a duratei lor in exploatare.
4.6.1 Coroziunea galvanica
Scopul lucrarii
Determinarea influentei suprafetei catodice (cuprului, aluminului) asupra coroziunii galvanice a zincului (sau fierului) in mediu neutru de apa de mare.
Introducere
Coroziunea galvanica reprezinta distrugerea in medii corozive a sistemelor formate din doua metale diferite in contact direct sau care sunt interconectate printr-un conductor electronic. Aceasta forma de coroziune se intalneste frecvent la imbinari prin sudura, la contactul fier si zinc (tabla zincata), la cupru si alama in schimbatoarele de caldura.
Dupa aspectul atacului coroziv, coroziunea galvanica reprezinta o forma de coroziune locala si este in acelasi timp o coroziune electrochimica, datorita mecanismului electrochimic al degradarii materialului metalic expus mediului coroziv.
Coroziunea locala influenteaza mult proprietatile mecanice ale pieselor, deci numai anumite sectiuni sunt slabite. Deoarece rezistenta unei constructii in ansamblu depinde de rezistenta sectiunii celei mai slabe, coroziunea locala este foarte periculoasa si aduce mari prejudicii economice.
 Coroziunea galvanica are loc pe seama
functionarii unor macropile de coroziune. In conditiile contactului intre doua
metale, metalul cu potential de coroziune mai negativ se corodeaza mai intens
si reprezinta anodul cuplului galvanic, iar cel cu potential de coroziune mai
putin negativ devine catodul sistemului bimetalic (fig. 4.6.1.1). De exemplu,
coroziunea zincului de pe otelul galvanizat are loc datorita functionarii pilei
galvanice Fe-Zn si determina consumarea zincului sau in cablurile electrice
Feral (Fe-Al), fierul neacoperit formeaza cu aluminiu o pila locala de
coroziune galvanica Fe-Al, ce conduce la degradarea cablurilor electrice.
Coroziunea galvanica are loc pe seama
functionarii unor macropile de coroziune. In conditiile contactului intre doua
metale, metalul cu potential de coroziune mai negativ se corodeaza mai intens
si reprezinta anodul cuplului galvanic, iar cel cu potential de coroziune mai
putin negativ devine catodul sistemului bimetalic (fig. 4.6.1.1). De exemplu,
coroziunea zincului de pe otelul galvanizat are loc datorita functionarii pilei
galvanice Fe-Zn si determina consumarea zincului sau in cablurile electrice
Feral (Fe-Al), fierul neacoperit formeaza cu aluminiu o pila locala de
coroziune galvanica Fe-Al, ce conduce la degradarea cablurilor electrice.
Fig 4.6.1.1 Celulǎ simplǎ electrochimicǎ cu componentele necesare coroziunii
Efectele coroziunii galvanice sunt neglijabile atunci cand diferenta intre potentialele de coroziune ale celor doua metale sunt mai mici de 50 [mV].
Trecerea curentului de coroziune in cuplurile galvanice este determinata de:
- dizolvarea anodica a metalului cu potential de coroziune mai negativ (ex. Zn fata de Fe in cazul cuplului galvanic Fe-Zn si Al in cazul cuplului galvanic Fe -Al );
M Mz+ + ze-
De exemplu: Zn Zn2+ + 2e- (4.6.1.2)
si de reducerea depolarizantului (pe catod), fie ionii de hidrogen:
H+ + e- H (4.6.1.3)
mai rar, sau mai des intalnita este reducerea oxigenului dizolvat in apa:
O2 + 2H2O + 4 e- 4HO-
pe metalul cu potential de coroziune mai pozitiv.
Raportul dintre suprafata anodica si catodica este esential pentru determinarea vitezei de coroziune. Se prefera o valoare cat mai mare a acestui raport, recomandandu-se ca piesele cu suprafata mica (suruburi, bolturi, suduri) sa fie executate din materiale mai nobile. In acest caz, piesele mici vor fi protejate catodic.
Importanta suprafetei este deosebit de mare in special pentru coroziunea sub control catodic cand reactia lenta a procesului global de coroziune este:
M+z/4O2 +z/2 H2O M(OH)z. (4.6.1.5)
Daca aria catodica este mare, cantitatea de oxigen ce se reduce este mare, densitatea de curent va fi apreciabila si deci coroziunea va fi intensa.
Deoarece legea lui Faraday se aplica si pentru coroziunea electrochimica la fel ca pentru orice reactie electrochimica, cantitatea m de metal ce trece in solutie in urma procesului de ionizare a metalului se determina cu ajutorul relatiei (4.6.1.6):
![]() (4.6.1.6)
(4.6.1.6)
unde: k - este echivalentul electrochimic;
q = i·t, reprezinta cantitatea de electricitate ce trece intre zonele anodice si catodice ale metalului supus coroziunii in timpul t, [sec];
ia- intensitatea curentului de dizolvare anodica exprimata in Amperi; F- constanta lui Faraday, F= 96500 [A·s];
z- numarul de electroni ce se elibereaza in procesul anodic;
A- masa atomica a metalului supus coroziunii .
![]() (4.6.1.7)
(4.6.1.7)
unde, S reprezinta suprafata metalului supus coroziunii exprimata in [m2], iar t= 3600 [sec].
Din relatia (4.6.1.7) rezulta ca
determinarea vitezei de coroziune se reduce la determinarea densitatii
curentului de dizolvare anodica ![]() .
.
Aparatura si substante: pahar Berzelius cu apa sarata (NaCl 3%), electrozi de Al, Cu, Zn si Fe, miliampermetru.
Mod de lucru
Se curata electrodul de zinc si cel de cupru cu hartie de smirghel. Se fixeaza electrodul de zinc paralel cu cel de cupru si se introduc in paharul cu mediul coroziv, NaCl 3%, ce reprezinta un mediu marin simulat. Cu ajutorul surubului de prindere se fixeaza placuta de cupru pentru suprafata maxima in solutie. Se fac legaturile la miliampermetru (fig. 4.6.1.2). Se noteaza variatia curentului din minut in minut timp de 10 minute.
In primele minute se constata o intensitate mai mare datorita cantitatii mari de oxigen aflata la suprafata electrodului. Treptat, intensitatea curentului scade tinzand spre o valoare constanta determinata de echilibrul dintre oxigenul necesar procesului de reducere si oxigenul care difuzeaza spre electrod. Mentinand anodul de zinc in aceeasi pozitie se fac pe rand aceleasi masuratori de curent in timp pentru inca doua suprafete diferite ale aceleasi placute de cupru. In tot timpul masuratorilor distanta dintre electrozi trebuie sa fie constanta. Acelasi procedeu de pregatire a electrozilor se aplica si pentru cuplul format din: anod de Fe si catod de Al.
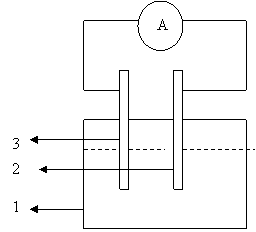
vas cu mediu coroziv (NaCl 3%)
a) Primul Cuplu: 2 - Anod (Zn)
3 - Catod (Cu)
b) Al doilea Cuplu: 2 - Anod (Al)
3 - Catod (Fe)
A. miliampermetru
Fig. 4.6.1.2. Montaj pentru coroziunea galvanica
Cele trei suprafete ale placutei de cupru, respectiv de fier folosite in determinarile experimentale se masoara cu rigla.
Rezultate si calcule
Datele experimentale se vor trece in tabelul urmator:
|
Timp [min] |
Intensitate curentului [mA] |
|||||
|
Cuplul Zn-Cu |
Cuplul Al-Fe |
|||||
|
| ||||||
|
Suprafata 1[cm2] | ||||||
|
Suprafata 2[cm2] | ||||||
|
Suprafata 3[cm2] | ||||||
Interpretare rezultate:
Se va reprezenta grafic dependenta curent - timp corespunzatoare celor 3 suprafete ale electrodului de cupru, respectiv de fier.
Se va reprezenta grafic dependenta valorii curentului dupa 10 minute functie de suprafata catodului.
Se vor scrie reactiile de la anod si de la catod care au loc in cazul celor doua tipuri de cupluri galvanice.
Se
calculeaza viteza de coroziune medie pe cele trei suprafete cu formula
(4.6.1.7). (ACu = [64 g/mol]; AFe = 56 [g/mol]; AZn =
65,38 [g/mol]; AAl = 27 [g/mol]; F = 96500 ![]() = 26,8
= 26,8 ![]() .
.
|