Curbe i-E (voltamograme)
Oxidarea si reducerea unui substrat organic, in particular formarea si reactiile intermediarilor in procesele redox organice, pot fi mult mai usor studiate electrochimic decat prin metodele clasice de oxidare si reducere chimica.
Uzual, comportamentul electrochimic al 121f59b unei specii este interpretat prin inregistrarea voltamogramei; aceasta este reprezentarea curent vs potential. Metoda voltametrica implica o celula electrochimica si circuitul electric necesar fiind inregistrat curentul de electroliza si potentialul electrodului de lucru fata de un electrod de referinta. Potentialul electrodului de lucru este variat (baleiat) intr-un anumit interval de potentiale. Cresterea curentului de electroliza este observata la o anumita valoare a potentialului electrodului de lucru la care incepe electroliza substratului. Conventia general acceptata pentru reprezentarea datelor voltametrice este un grafic in care potentialul este reprezentat pe abscisa iar curentul pe ordonata. Procesele catodice care au loc, de obicei, la potentiale negative fata de electrodul de referinta, sunt reprezentate in partea stanga, iar procesele anodice in partea dreapta. Prin conventie, curentii catodici sunt negativi si reprezentati sub abscisa. Voltamogramele proceselor de reducere sunt inregistrate prin baleierea potentialului de la dreapta la stanga. Voltamogramele anodice se obtin printr-o baleiere a potentialului de la stanga la dreapta, curentii anodici rezultati sunt pozitivi si reprezentati deasupra abscisei.
Voltamogramele substantelor A si B obtinute printr-o baleiere a potentialului de la stanga la dreapta demonstreaza ca A este mai usor de oxidat decat B (figura 7.1).
Examinarea voltamogramelor pentru reducerea substantelor C si D scoate in evidenta ca substanta C este mai usor de redus decat D. De asemenea, se observa ca oxidarea lui B si reducerea lui C au loc la acelasi potential, E1. cand B si C formeaza un cuplu redox, B este forma oxidata a lui C, iar potentialul E1 este egal cu potentialul standard al cuplului redox, E0.
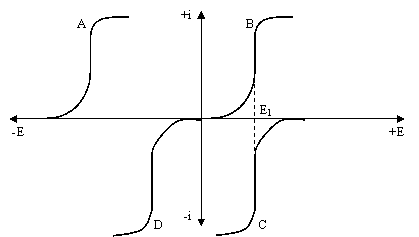
Fig. 7.1 Curbe de polarizare de oxidare (A, B) si reducere (C,D).
Nicholson si Shain au aratat ca forma voltamogramelor depinde de o serie de efecte ca: difuzia, reactiile chimice cuplate transferului de electroni, viteza de baleiere etc., pentru un mecanism de electrod dat. folosind notatiile autorilor, diferite mecanisme considerate de ei includ:
1) Transfer de electroni reversibil.
O + nē ↔ R (VII.1)
2) Transfer de electroni ireversibil.
O + nē → R (VII.2)
3) Transfer de electroni reversibil precedat de reactie chimica.
Z ↔ O (VII.3)
O + nē ↔ R (VII.4)
4) Transfer de electroni reversibil precedat de reactie chimica.
Z ↔ O (VII.5)
O + nē → R (VII.6)
5) Transfer de electroni reversibil urmat de reactie chimica reversibila.
O + nē ↔ R (VII.7)
R ↔ Z (VII.8)
6) Transfer de electroni reversibil urmat de reactie chimica ireversibila.
O + nē ↔ R (VII.9)
R → Z (VII.10)
7) Transfer de electroni reversibil cu reactie catalitica.
O + nē ↔ R (VII.11)
R + Z → O (VII.12)
8) Transfer de electroni ireversibil cu reactie catalitica.
O + nē → R (VII.13)
R + Z → O (VII.14)
|