ELECTROCHIMIE
Consideratii teoretice
Solutii de electroliti. Din punct de vedere al comportarii substantei dizolvate, solutiile se pot clasifica in solutii de neelectroliti si solutii de electroliti. In solutie, neelectrolitii se gasesc sub forma de molecule sau asociatii de molecule.
Electrolitii sau conductorii de ordinul II sunt substante care in stare topita sau prin dizolvare intr-un solvent polar conduc curentul electric cu transport de materie, deoarece se desfac in particule cu sarcini electrice pozitive sau negative, numite ioni. Procesul de desfacere sub forma de ioni mobili a electrolitilor poarta numele de disociere electrolitica si are loc anterior si independent de trecerea curentului electric.
Proprietatea unui electrolit de a conduce curentul electric se numeste conductibilitate electrica, iar marimea fizica asociata fenomenului se numeste conductivitate.
Tipuri de electroliti
Electrolitii reali sau ionofori in stare solida cristalizeaza in retea ionica (de exemplu: NaCl, KCl) si deci, ionii preexista in reteaua cristalina. Legatura ionica din cristale poate fi stabilizata fie prin topirea substantei si astfel, rezulta o topitura ionica conductoare, fie prin dizolvarea intr-un solvent polar adecvat, cand ionii trec in solutie, ca urmare a interactiunii lor cu moleculele dipolare din solvent, prin formare de legaturi ion-dipol, rezultand ioni solvatati (hidratati, daca solventul este apa).
De exemplu: ![]() (4.1)
(4.1)
Electrolitii potentiali sau ionogeni in stare solida cristalizeaza in retele moleculare. In nodurile retelei cristaline sunt moleculele polare, formate din atomi legati covalent. Ionii apar la dizolvarea electrolitului in apa sau in alt solvent polar, ca urmare a accentuarii polaritatii legaturii covalente si a ruperii ei, sub ac 959j98j tiunea moleculelor polare de solvent.
De exemplu: ![]() (4.2)
(4.2)
legatura covalenta polara
Electrolitii ionofori disociaza complet in ioni atunci cand sunt dizolvati in solventi polari. Cei ionogeni disociaza complet cand polaritatea legaturii covalente este mare si partial, cand polaritatea legaturii este mica.
Proprietatea solutiilor de electrolit de a conduce curentul electric poate fi caracterizata si evaluata cantitativ prin conductivitatea lor electrica.
Solutiile de electrolit sunt conductori ionici (de ordin II) si la fel ca in cazul conductorilor de ordin I li se aplica legea lui Ohm :
![]() (4.3)
(4.3)
unde, E - tensiunea exprimata in volti, [V];
R - rezistenta exprimata in Ohm, [W
I - intensitatea curentului exprimata in amperi [A].
Rezistenta conductorilor de ordin I (conductori electronici sau metalici) este data de relatia:
![]() (4.4)
(4.4)
unde, r - rezistivitatea sau rezistenta specifica, [W*cm] ;
l - lungimea conductorului sau distanta dintre electrozi, [cm];
S - sectiunea conductorului, [cm2].
Din relatia (1.4) se obtine :
![]() (4.5)
(4.5)
Conductanta, G este marimea inversa rezistentei, R si se exprima in [W ] sau Siemens [S].
![]() (4.6)
(4.6)
Conductivitate, l este marimea inversa rezistivitatii, r si se exprima in [W cm-1] sau [Scm-1] si reprezinta conductanta unui cm3 de solutie de electrolit ce se gaseste intre electrozii inerti avand aceeasi suprafata de 1cm2 si aflati la distanta de 1cm.
![]() (4.7)
(4.7)
Pentru a masura conductivitatea electrica a solutiilor de electrolit se folosesc celule de conductivitate. Masurarea se efecueaza montand celula de conductivitate la aparate numite conductometre. Conductometrul este legat de o celula de conductivitate, formata dintr-un vas de sticla, in interiorul caruia sunt montati in pozitie fixa doi electrozi din metal inert (Pt), avand suprafete egale.
Celulele de conductivitate sunt caracterizate de o marime numita constanta celulei, K.
![]() (4.8)
(4.8)
unde, l - distanta dintre electrozi, [cm];
S - suprafata electrozilor, [cm2].
Conductivitatea solutiilor de
electroliti variaza cu concentratia ![]() , crescand odata cu cresterea concentratiei, atingand un
maxim si apoi scazand cu cresterea in continuare a concentratiei.
, crescand odata cu cresterea concentratiei, atingand un
maxim si apoi scazand cu cresterea in continuare a concentratiei.
Pozitia maximului depinde de natura electrolitului si de temperatura. Variatia este mai mare pentru electrolitii tari decat pentru cei slabi. In general, in solutii diluate, creste cu concentratia, deoarece creste numarul unitatilor conductoare, iar in solutii concentrate, scade cu concentratia, deoarece intervine procesul de asociere a ionilor de sarcini opuse in compusi neconductori.
Variatia conductivitatii si a pH-ului solutiilor de electroliti cu concentratia
Scopul lucrarii
Se determina constanta de disociere Kd, gradul de disociere a si pH-ul atat pentru un electrolit slab, acid acetic (CH3COOH) cat si pentru un electrolit tare, clorura de sodiu (NaCl) pentru a studia variatia conductivitatii si a pH-ului acestora cu concentratia.
Introducere
Pentru compararea din punct de vedere al conductivitatii electrice solutiilor de electroliti diferiti se defineste o alta marime, conductivitatea echivalenta, L care reprezinta conductivitatea ionilor, l raportata la un echivalent-gram de electrolit dizolvat intr-un volum, V (cm3) de solutie.
![]() , unde
, unde ![]() si reprezinta dilutia (4.1.1)
si reprezinta dilutia (4.1.1)
![]() (4.1.2)
(4.1.2)
V este volumul exprimat in cm3 de solutie ce contine un echivalent chimic din electrolitul considerat, iar C este concentratia normala a lui.
![]() (4.1.3)
(4.1.3)
iar ![]() [W cm2/echiv.] sau [Scm2 / echiv.] (4.1.4)
[W cm2/echiv.] sau [Scm2 / echiv.] (4.1.4)
Conductivitatea echivalenta L creste cu dilutia si tinde catre o valoare maxima limita L , atinsa la dilutie infinita, cand disocierea electrolitului este completa. Pentru determinarea lui Lo se determina L la diferite concentratii alei unei solutii de electrolit si se extrapoleaza la C = 0.
Disocierea unui electrolit se exprima cantitativ prin doua marimi:
Constanta de disociere Kd - egala cu constanta de echilibru a procesului reversibil de echilibru ce are loc intre ionii si moleculele nedisociate ale electrolitului.
Grad de disociere a - o marime fizico-chimica introdusa de Arrhenius ce reprezinta raportul dintre numarul de molecule disociate si numarul total de molecule dizolvate si se exprima prin raportul dintre L si L
![]() (4.1.5)
(4.1.5)
Kd si a reprezinta un criteriu de clasificare a electrolitilor:
Kd > 1 si a = 1 - electroliti tari, practic complet disociati in solutii de concentratii cuprinse intre 0,1 si 0,001M;
Kd < 10-2 si a < 0,5 – electroliti slabi chiar si in solutii de concentratii mai mici de 0,01 M;
10-2 < Kd < 1 si 0,5 < a < 0,8 – electroliti medii.
Kd = a c / (1- a - legea dilutiei lui Ostwald (4.1.6)
Legea dilutiei lui Ostwald exprima legatura dintre Kd si a si se aplica doar pentru electrolitii slabi, deoarece in cazul electrolitilor tari, a creste cu dilutia si nu se mai obtin valori constante pentru Kd.
Inlocuind pe a din relatia (4.1.5) in relatia (4.1.6) se obtine:
![]() (4.1.7)
(4.1.7)
Electrolitii pot fii: acizi, baze sau saruri. In continuare sunt prezentate procesele de disociere in cazul electrolitilor tari
|
Disociere acid tare |
Disociere baza tare |
Disociere sare |
|
H2SO4 2H+ + SO4 2- |
Cu(OH)2 Cu2+ + 2HO- |
NiSO4 Ni2+ + SO42- |
|
|
|
|
unde, “C” este concentratia electrolitilor
In cazul electrolitilor slabi: Apa este un electrolit foarte slab, doar o molecula de apa din 550.000.000 disociaza:
H2O ⇄ H++ HO- (4.1.8)
sau 2H2O ⇄ H3O++ HO- (4.1.9)
deoarece ionul de H+ nu se gaseste liber. Constanta de disociere va fi:
![]() ; dar, Kd[H2O]= const. = [H+]·[HO-]
= Kw = produsul ionic al
apei.
; dar, Kd[H2O]= const. = [H+]·[HO-]
= Kw = produsul ionic al
apei.
La 250C, Kw=10-14 [mol/L2]. Pentru apa neutra, [H+] = [HO-] = 10-7[mol/L].
Fata de apa neutra solutiile pot fi: - acide, daca [H+] > 10-7
- bazice, daca [H+] < 10-7.
CH3COOH H+ + CH3COO- (4.1.10) 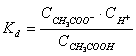 (4.1.11)
(4.1.11)
Aciditatea unei solutii se poate exprima prin marimea fizico-chimica numita pH.
In
cazul solutiilor ideale, 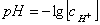 (4.1.12)
(4.1.12)
sau in cazul solutiilor reale, ![]()
![]() (4.1.13)
(4.1.13)
unde, aH+- concentratia activa sau activitatea;
![]() (4.1.14)
(4.1.14) ![]() (4.1.15)
(4.1.15)
unde, f – factor de activitate al electrolitului, depinde de natura
substantei, de temperatura si de concentratie. Tinde catre 1 cand dilutia
creste: ![]() si
si ![]()
Pentru solutii apoase, pH Є Daca pH < 7 solutiile au caracter acid, daca pH > 7 solutiile au caracter bazic. Pentru pH = 7 solutiile au caracter neutru.
 Aparatura si substante: conductometru - inoLab® pH/Cond
720 (fig. 4.1.1), electrod de conductivitate, electrod de pH, pahare
Berzelius, solutii de CH3COOH si NaCl de concentratii diferite, solutie de KCl 0,01N.
Aparatura si substante: conductometru - inoLab® pH/Cond
720 (fig. 4.1.1), electrod de conductivitate, electrod de pH, pahare
Berzelius, solutii de CH3COOH si NaCl de concentratii diferite, solutie de KCl 0,01N.
Mod de lucru
electrodul de conductivitate aflat in paharul Berzelius ce contine apa distilata se scoate si sterge cu hartie de filtru;
se scoate capacul protector al electrodului de pH.
Se spala in apa distilata electrodul de pH, apoi se sterge cu hartie de filtru;
Fig. 4.1.1 Conductometru - inoLab® pH/Cond 720
se conecteaza conductometrul la reateaua de alimentare cu curent electric;
electrodul de conductivitate se cupleaza la conductometru. Se porneste aparatul, apasand butonul “ON/OFF“ si apoi butonul “▲▼, pana apare scala de citire a conductivitatii l exprimata in [ S/cm];
electrodul de conductivitate se introduce pe rand in 4 pahare Berzelius ce contin solutii de CH3COOH (0.001N, 0.01N, 0.1N si 1N) in ordinea crescatoare a concentratiei. Pentru a face prima citire de conductivitate se apasa butonul “AR” pana ce apare pe ecranul aparatului in dreapta jos scris “AR”. Apoi se apasa “Enter” si incepe sa clipeasca pe ecran “AR”. Se asteapta ca acesta sa ramana fix pe ecran dupa care se noteaza valoarea conductivitatii l in tabelul de mai jos. Se procedeaza in acelasi mod pentru toate citirile de conductivitate si pHmas, spaland si stergand electrodul intre masuratori.
electrodul de conductivitate se introduce pe rand in 4 pahare Berzelius ce contin solutii de NaCl 0.001N, 0.01N, 0.1N si 1N) in ordinea crescatoare a concentratiei si se citesc valorile conductivitatii;
electrodul de pH se cupleaza la aparat. Se porneste aparatul, apasand butonul “ON/OFF“ si apoi butonul “▲▼, pana apare scala de citire a pH-ului;
electrodul de pH se introduce pe rand in cele 8 pahare Berzelius ce contin solutii de CH3COOH si NaCl in ordinea crescatoare a concentratiei si se citesc valorile pH-ului.
dupa terminarea determinarilor se opreste aparatul, se spala electrodul de conductivitate si cel de pH. Electrodul de conductivitate se introduce in paharul Berzelius cu apa distilata, iar celui de pH i se pune capacul protector.
Rezultate si calcule
Se intocmeste tabelul urmator cu datele experimentale obtinute:
|
Solutie |
CN |
[S/cm] |
[Scm2] |
a |
Kd |
cH+ |
pHcal |
pHmas |
|
CH3COOH | ||||||||
|
| ||||||||
|
NaCl | ||||||||
Pentru solutiile de electrolit slab, (CH3COOH) se calculeaza:
conductivitatea echivalenta L cu ajutorul relatiei (4.1.4);
gradul de disociere a folosind relatia (4.1.5), stiind ca valoarea conductivitatii echivalente limita L = 380 Scm2
constanta de disociere Kd pe baza relatiei (4.1.6);
concentratia ionilor de hidrogen, (CH+) cu relatia (4.1.15) si pHcalc cu relatia (4.1.13)
In cazul electrolitilor tari, (NaCl):
se calculeaza
L si se reprezinta grafic dependenta ![]() . Prin extrapolare se va stabili valoarea L Se calculeaza apoi L a,
Kd, CH+ si pHcalc.
. Prin extrapolare se va stabili valoarea L Se calculeaza apoi L a,
Kd, CH+ si pHcalc.
Se reprezina grafic ![]() si
si ![]() pentru toate solutiile
de electroliti.
pentru toate solutiile
de electroliti.
|