ENERGETICA CHIMICĂ
Energetica reactiilor chimice
10.5. Energetica reactiilor chimice
Rearanjarea atomilor care apare īntr-o transformare chimica este apropar īntotdeauna īnsotita de eliberare sau absorbtie de caldura. Daca scopul unei reactii este furnizarea de caldura, cum ar fi de exemplu arderea combustibililor, atunci caldura emisa este cea de interes direct. Vom vedea īnsa ca la un studiu mai aprofundat, ca modificarile energetice aparute alaturi de o modificare chimica ne va ajuta a īntelege mai usor echilibrul chimic si a modificarii chici īnsasi.
Īn termodinamica chimica definit starea de zero a entalpiei si a energiei interne modul de existenta a elementelor lasa cum exista ele la 298 K si 1 atm. Astfel entalpiile H pentru Xe (g), O2 (g), C (diamant) sunt toate zero, precum si cele ale H2 si Cl2 din reactia
![]()
Entalpia a doi moli de HCl este mai mica decāt cea a reactantilor, astfel īncāt diferenta este eliminata ca si caldura. O astfel de reactie este definita drept reactie exoterma. Inversa ei se defineste drept reactie endoterma, deoarece absoarbe caldura din vecinatate pentru a avea loc.
Īn comparatie dintre energiile interne si entalpiile diferitelor substante care o vom 252i86c face aici, este important sa se considere acelasi numar de moli, energia fiind o proprietate extensiva a materiei. Totusi, caldurile de reactie sunt exprimate pe baza molaritatii si tratate drept o proprietate intensiva.
10.5.1. Modificari ale entalpiei si a energiei interne
Am caracterizat orice reactie chimica prin intermediul modificarii energiei sale interne sau a entalpiei:
DH = Hfinal - Hinitial
Semnificatia acesteia poate fi greu exagerata deoarece DH, fiind o ecuatie de stare, este complet independenta de modul īn care sistemul ajunge īn starea finala pornind de la starea initiala. Cu alte cuvinte, valoarea lui DH sau DU pentru o anumita modificare de stare este independenta de calea urmata de proces.
Sa consideram, de exemplu, oxidarea zaharului la dioxid de carbon si apa:
![]()
Acest proces poate fi efectuat īn diferite moduri ca: māncarea zaharului si permitānd corpului nostru sa produca oxidarea sau prin arderea zaharului īn aer. Cu toate ca mecanismele sunt total diferite pentru cele doua cai mentionate aici, modificare globala a entalpiei sistemului va fi identica si se poate calcula simplu din entalpiile reactantilor si produsilor (vezi pagina 19!!!) si calculānd diferenta
DH = H(CO2) + 11 H(H2O) - H(C12H22O11) = -5606 kJ
Aceiasi cantitate este eliberata atunci cānd zaharul este ars īn aer sau oxidat printr-o serie de cai catalizate enzimatic īn corpul uman.
10.5.2. Variatia entalpiei cu temperatura
Entalpia unui sistem creste cu temperatura printr-o cantitate egala cu DH CPDT. Definind relatia DH DU PDV ne indica ca aceasta schimbare este dominata de energia interna, supusa unei mici corectii datorate de lucru asociat modificarii volumului. Īncalzirea unei substante determina expansiunea ei, facānd pozitiv DV si determinānd cresterea entalpiei cu ceva mai mult decāt cresterea energiei interne. Din punct de vedere fizic aceasta īnseamna ca daca temperatura creste si mentinem constanta presiunea, este nevoie de o anumita energie īn plus pentru a contracara presiunea care se opune expansiunii sistemului. Diferenta dintre dependenta valorilor U si H de temperatura are o semnificatie reala doar īn cazul gazelor, deoarece coeficientul de expansiune ( dilatare) a lichidelor si solidelor este extrem de mic.
Schimbarile de faza
Reprezentarea entalpiei unui sistem ca functie de temperatura lui este definita drept o diagrama a entalpiei. Panta este data de valoarea Cp. Diagrama entalpiei unei substante pure precum apa arata ca panta ei nu este uniforma, fiind īntrerupta īn pozitii īn care valoarea Cp este aparent infinita, īnsemnānd ca substanta poate absorbi sau ceda caldura fara a suferii nici o modificare īn temperatura ei. Aceasta este de fapt ceea ce se īntāmpla cānd o substanta sufera o schimbare de faza; stim cu totii ca apa nu poate depasii 100 0C deoarece peste aceasta temperatura, la presiune normala, 1 atm. Apa se transforma total īn vapori.
|
Figura 10.6. Entalpia tetraclorurii de carbon ca functie de temperatura la 1 atm Reprezentarea entalpiei unui sistem ca functie de temperatura lui este definita drept o diagrama a entalpiei si reprezinta o privire concisa si exacta asupra comportarii ei termice. Panta este data de valoarea Cp Diagrama entalpiei unei substante pure precum apa arata o anumita neregulalitate, fara a fi īnsa īntrerupta si la care valoarea Cp este aparent infinita, īnsemnānd ca substanta poate absorbi sau ceda caldura fara o modificare a temperaturii ei. Asta este exact ceea ce se īntāmpla cānd o substanta sufera o schimbare de faza Cea mai mica discontinuitate īn modificarea de faza īn cazul tetraclorurii de carbon apare la tranzitia de faza solid - lichid. |
|
Topirea si evaporarea nu sunt singurele modificari de faza pe care le sufera materia. Majoritatea solidelor pot exista īn diferite modificari structurale la diferite temperaturi ducānd la modificari de stare asemanatoare celor induse de discontinuitati ale capacitatii lor calorice. Diagramele de entalpie sunt determinate simplu urmarind temperatura unei probe din acestea. Diagramele rezultate sunt des utilizate īn stiinta materialelor dar si īn caracterizarea unor substante noi obtinute prin cercetare de avangarda.
10.6. Termochimia
Caldura care trece prin granitele unui sistem sufera a modificare a unei proprietati fundamentale care caracterizeaza procesul. Este usor de masurat si daca procesul este a reactie chimica care are loc la o presiune constanta, dar poate fi de asemenea prevazuta prin diferenta dintre entalpiile produselor si reactantilor. Studiul cantitativ si masurarea modificarilor de temperatura si temperatura este cunoscut sub denumirea de termochimie.
10.6.1. Ecuatii termochimice si stari standard
Pentru a definii proprietatile termochimice ale unui proces, este īn primul rānd necesar de a crie o ecuatie termochimica care definesc schimbarile care au loc, atāt īn termenul formulelor substantelor implicate cāt si proprietatile lor fizice (temperatura, presiune, fie solid, lichid sau gaz). Sa luam un exemplu simplu, cel al ecuatiei termochimice a vaporizarii apei la puntul normal de fierbere:
H2O(l, 373 K, 1 atm) H2O(g, 373 K, 1 atm) DH = 40,7 kJ mol-1
Cantitate de 40,7 kJ mol-1 este cunoscut[ sub denumirea de entalpie de vaporizare (caldura de vaporizare) a apei lichide. Atunci cānd scriem ecuatii termodinamice trebuie sa tinem cont de urmatoarele:
a. - ecuatiile termodinamice ale reactiilor care au loc īn solutii trebuie sa specifice concentratiaspeciilor diziolvate. De exemplu, entalpia de neutralizare a unui acid tare cu o baza tare este:
H+(aq, 1M, 298 K, 1 atm) + OH-(aq, 1M, 298 K, 1 atm) H2O(l, 373 K, 1 atm) DH =56.9 kJ mol-1
Unde abrevierea aq se refera la ionii hidratati asa cum sunt ei prezenti īn solutiile apoase. Deoarece majoritatea ecuatiilor termodinamice sunt scrise pentru conditii standard la 298 K si 1 atm, putem considera aceste cantitati īn afara daca conditiile suntt pastrate si īn transformarile ulterioare. Daca īn acelasi conditii o substanta se afla in starea ei fizica preferata, se spune despre ea ca este īn stare standard; astfel pentru apa sub 00C si 1 atm starea standard este cea solida iar peste 1000C este cea gazoasa. O cantitate termodinamica precum DH care face referinta la substante īn starea lor standard se noteaza DH0
b. - Īn cazul substantelor dizolvate, starea standard este cea a "concentratiilor efective" cunoscuta sub definirea de activitate si fiind egala cu unitatea. Pentru solutii neionici activitatea si molaritatea sunt aproape identice pentru concentratii de pāna la 1 M, dar īn cazul substantelor ionice solubilizate aceasta generalizare este valabila doar pentru solutii cu dilutii sub 0,001 respectiv 0,01 m, depinzānd de sarcina electrica a ionului si de dimensiunea lui.
c. - Orice cantitate termodinamica precum DH care este asociata cu o ecuatie termodinamica face referinta de asemenea la numarul de moli a substantei respective mentionati explicit īn reactie. Astfel sinteza apei poate fi scrisa sub forma:
2 H2(g) + O2(g 2 H2O(l) DH = -572 kJ
sau
H2(g) + 1/2 O2(g) H2O(l) DH = -286 kJ
10.6.2. Entalpia de formare
Modificarea entalpiei unei reactii chimice reprezinta diferenta:
DH = H produsi - H reactanti
Daca reactia respectiva reprezinta formarea unei substante din elementele componente īn stare standard precum īn reactia:
H2(g) + 1/2 O2(g) H2O(l) DH = -286 kJ
Se poate aloca arbitrar elementelor valoarea entalpiei ca fiind zero si īn consecinta putem scrie:
Hf ° SHf °produsi SHf °reactanti = -286 kJ - 0 = -268 kJ mol-1
Care defineste entalpia standard de formarea a apei la 298 K.
Entalpia standard de formare a unui compus este caldura asociata formarii unui mol din substanta respectiva din elementele constitutive, īn conditiile sale standard.
Īn general modificarea entalpiei standard a oricarei ecuatii este data modul īn care expresia SHf ° reprezinta suma entalpiilor standard de formare a tuturor produsilor si reactantilor.
Definitia anterioara este una din cele mai importante din chimie deoarece permite sa prezicem modificarile entalpiei oricarei reactii fara a cunoaste nimic altceva decāt entalpiile standard de formare a produsilor si reactantilor, care pot fi oricānd obtinute din tabele.
Urmatoarele exemple ilustreaza unele aspecte importante ale entalpiei standard de formare a substantelor.
- Ecuatia termodinamica definind Hf0 este īntotdeauna scrisa īn termenii unui mol ale substantei respective:
1/2 N2(g) + 3/2 H2(g) NH3(g) DH° = -46,1 kJ mol-1
- Anumite elemente, dintre care citam carbonul si sulful, pot exista īn mai multe forme solide cristaline: Caldura standard de formare a unui compus este luata īntotdeauna pentru forma cea mai stabila īn conditii standard 250C si 1 atm. Pentru carbon aceasta corespunde formei grafit mai degraba decāt diamantului:
C(graphite) + O2(g) CO2(g) DH° = -393.5 kJ mol-1
C(diamond) + O2(g) CO2(g) DH° = -395.8 kJ mol-1
- Starea fizica a produsului unei reactii de formare trabuie indicata explicit deca nu reprezinta starea ei stabila pentru conditiile standard, 250C si 1 atm:
H2(g) + 1/2 O2(g) H2O(l) DH° = -285.8 kJ mol-1
H2(g) + 1/2 O2(g) H2O(g) DH° = -241.8 kJ mol-1
Notati diferenta dintre cele doua valori de formare, reprezinta chiar caldura de vaporizare a apei!!
4. - Cu toate ca majoritatea reactiilor de formare a substantelor din elementele constitutive sunt procese exoterme, īn unele cazuri ele reprezinta procese mediu endoterme:
1/2 N2(g) + O2(g) NO2(g) DH° = +33,2 kJ mol-1
O caldura pozitiva de formare este frecvent asociata instabilitatii -tendinta unei molecule de se descompune spontan īn elementele constitutive. Īn multe cazuri īnsa viteza unei astfel de descompuneri este practic zero, astfel īncāt o astfel de substanta poate exista.
5. - Reactiile termodinamice care definesc caldurile de formare a majoritatii compusilor nu pot avea practic loc; de exemplu sinteza directa a metanului din elementele constitutive
C(grafite) + 2 H2(g) CH4(g)
nu poate fi determinata direct datorita modalitatilor diferite pe care aceasta reactie se poate desfasura. Totusi. Prin metode indirecte, asa cum se va prezenta mai jos, aceasta valoare poate fi calculata.
6. - Entalpia standard de formare a atomilor gazosi se cunoaste sub denumirea de caldura de atomizare Aceasta este īntotdeauna pozitiva, fiind deosebit de importanta pentru calcularea energiilor de legatura.
Fe(s) Fe(g) DH° = 417 kJ mol-1
7. - Caldura standard de formare a ionilor dizolvati precum Cl- (adica formarea ionului din aton) nu poate fi masurata datorita faptului ca este imposibil ca o solutie sa contina un singur ion. Din acest motiv entalpiile de ionizare sunt exprimate aparte, comparative cu valoarea Hf° considerata a fi unitatea activitate etalon (pentru o concentratie de 1 mol) fiind definita drept zero. Astfel pentru
Ca2+(aq), Hf° = -248 kJ mol-1
Adica:
Ca(s) Ca2+(aq) + 2e-(aq)
ca va elibera 248 kJ mol-1 mai mult decāt reactia:
1/2 H2(g) H+(aq) + e-(aq)
Bine-nteles nici una din aceste reactii nu poate fi determinate direct,
deci se va recurge la modalitatile indirecte.
Entalpia standard a formarii ionului de hidrogen este definita drept ZERO!
10.6.3. Legea lui Hess si calculele termodinamice
Se cunoaste ca doua sau mai multe reactii pot fi combinate algebric pentru a duce la u noua ecuatie chimica. Chiar īnainte de dezvoltarea stiintei termodinamicii aceasta a fost deja raportata de chimistul Germaine Hess (1802-1850). El mentiona faptul ca eliminarea caldurii īn cadrul reactiilor poate fi aditivat. De exemplu, entalpia standard de oxidare a grafitului si diamantului pot fi combinate pentru obtinerea valorii DH° pentru transformarile care au loc īntre aceste doua specii ale carbonului solid, care nu pot fi studiate experimental:
C(grafit) + O (g) CO (g) DH° = -393,51 kJ mol
C(diamant) + O (g) CO (g) DH° = -395,40 kJ mol
Daca scadem a doua ecuatie din prima rezulta:
C(grafit) C(diamant) DH° = 1,89 kJ mol
Acest principiu, cunoscut īn literatura stiintifica chimica drept legea lui Hess privind īnsumarea caldurilor individuale de formare este o consecventa inerenta a entalpiei ca functie de stare! Legea lui Hess reprezinta una din cele mai puternice unelte ale chimiei pe de o parte datorita faptului ca permite modificari ale entalpiei (sau ale altor functii termodinamice) ale unor numar incomensurabil ale reactiilor chimice, prezise pe baza unor date experimentale relativ putine.
Datorita faptului ca putine substante pot fi obtinute direct prin sinteza lor din elementele constitutive, caldurile lor de formare sunt determinate prin masuratori directe. Īn schimb, legea lui Hess este utilizata pentru calcularea entalpiilor din datele cele mai accesibile Dintre acestea cele mai importante sunt entalpiile standard de ardere. Cele mai multe elemente se combina cu oxigenul, multe din aceste oxidari fiind puternic exoterme, facānd determinarea valorilor lor relativ usoara.
De exemplu daca combinam caldurile de combustie ale carbonului, hidrogenului si metanului vom obtine entalpia standard de formare a metanului, car asa cum s-a mentionat anterior nu poate fi determinata direct. Entalpia standard de formare a ionului de hidrogen este zero asa cum s-a mentionat anterior
Entalpia standard de formare ale ionului de hidrogen este definit drept zero.
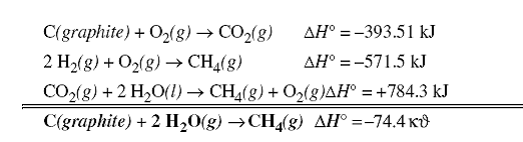
Caldura standard de atomizare se refera la transformarea a unei substante īn elemente īn stare atomice:
C(grafit) C(g) DH° = 716,7 kJ
Care este desigur, īntotdeauna un proces exotermic. Caldura de atomizare este cea mai utilizata data īn calculul energiilor de legatura.
|