Electrochimia legaturii duble
La reducerea electrochimica a oricarei legaturi duble, etapa initiala consta in acceptarea unui electron de catre orbitalul molecular neocupat de energie minima (lowest unfilled molecular orbital, LUMO) al legaturii duble. Aceasta definitie exclude procesele electrochimice ca reducerea alchinelor la cis alchene pe catod de nichel in mediu acid; aceste procese se denumesc mai corect ca hidrogenari catalitice prin intermediul hidrogenului generat electrochimic si nu reduceri electrochimice directe. Similar, oxidarea electrochimica presupune cedarea unui electron de catre orbitalii moleculari de nelegatura sau orbitalii moleculari ocupati de energie maxima (highest occupied molecular orbital, HOMO) ai substratului; in cazuri particulare, oxidarea anodica implica generarea electrochimica a unor specii ca: ClO2, NO3., PbO2.
In multe din cazuri oxidarea si reducerea electrochimica au loc direct, stiind ca acest lucru presupune cedarea unui electron de catre HOMO, respectiv acceptarea unui electron de catre LUMO. Astfel, alchenele sunt mai usor oxidate atunci cand legatura dubla este substituita cu grupe respingatoare de electroni si sunt mai usor reduse daca la legatura dubla sunt atasate grupe atragatoare de electroni.
Deoarece electronegativitatea atomului legat la atomul de carbon creste in ordinea C < N < O, este de asteptat ca reducerea sa se realizeze mai usor in ordinea 2 < 3 < 4;
X=Y: R2C=C< R2C=N- R2C=O
1 2 3 4
Intr-adevar, alchenele nu sunt reductibile electrochimic in conditiile in care sunt reduse iminele si compusii carbonilici; etanol sau apa continand saruri de tetraalchilamoniu ca electrolit suport. Un alt factor important este caracterul protic al solventului; trialchiliminele si dialchilcetonele nu sunt reductibile electrochimic in solventi aprotici dipolari, astfel, reducerea lor in solventi protici este asociata cu abilitatea solventului de a accepta protoni.
Produsul initial al transferului de electron catre substrat, pentru structurile 1 – 4, este un radical anion, care poate fi reprezentat astfel:
![]()
respectiv
![]() X = CR2,
NR, O
X = CR2,
NR, O
5 5a 5b
Deoarece electronegativitatea creste in ordinea C < N < O, structura de rezonanta 5a devine mult mai probabila pentru radical anionii din seria 2 -4. In cazul alchenelor nesubstituite sau substituite simetric, structurile 5a si 5b sunt echivalente; radical anionii alchenelor nesubstituite cu grupe activatoare (carbonil, nitro, cian etc.) nu pot fi generati la potentiale accesibile in solventi organici.
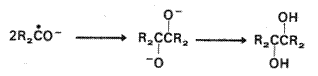
Radical anionii
compusilor carbonilici (cetili) sunt mai corect reprezentati de
structura 5a decat de structura 5b. Deoarece reactiile cetililor cu
electrofilii au loc la atomul de oxigen, procesele radicalice au loc la atomul
de carbon. De exemplu, dupa protonarea initiala la atomul de oxigen,
cetilii dimerizeaza la carbon, cu formarea de dioli vicinali, 6
(pinacoli).
(VII.112)
6
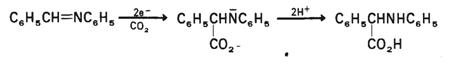
In cazul iminelor,
structura de rezonanta 5b este mai probabila, iar radical
anionii iminelor pot reactiona cu electrofilii atat la atomul de azot cat
si la atomul de carbon.
(VII.113)
Comportamentul electrochimic al compusilor de tipul X=Y depinde de pH. In medii alcaline sau solventi organici aprotici, radical anionii, 7 au stabilitate moderata iar dimerizarea are loc numai intr-o mica masura. In astfel de solventi este posibila acceptarea celui de-al doilea electron cu formarea unui dianion, 8. Datorita repulsiei electronice mari, dianionul se formeaza la potentialul E2 mai negativ decat E1 necesar formarii radical anionului.
![]() (VII.114)
(VII.114)
![]() 8 9
8 9
1 7
![]()
10 9
(VII.115)
In medii protice neutre sau solventi organici aprotici care contin donori de protoni, radical anionul poate fi protonat cu formarea unui radical neutru, 10 al carui potential de reducere E3 este, in general, mai pozitiv decat E1 si astfel este redus imediat dupa formare.
In medii protice puternice (pH foarte mic), etapa electrochimica initiala consta in reducerea acidului conjugat al speciei 1.
![]() (VII.116)
(VII.116)
Este generat, de asemenea, radicalul neutru, 10, dar doarece are loc la potentialul E4, radicalul are viata suficient de lunga pentru a participa la reactii ca dimerizarea; reactii neobservate atunci cand este generat in medii aprotice cu pH ridicat.
1 Electrochimia legaturii >C=C<
Din punct de vedere electrochimic, o alchena este mai usor oxidata si mai greu reductibila, deoarece este mai usor de atins potentiale anodice mari (la care alchena pierde un electron din orbitalul HOMO) fara sa participe la procese secundare cu solventul sau electrolitul, comparativ cu reducerea unde se pot atinge intotdeauna potentiale suficient de negative la care alchena sa accepte un electron in orbitalul LUMO. Chiar si in aceste conditii, oxidarea anodica a alchenelor este rar intalnita; in majoritatea cazurilor alchena este o parte a unui sistem conjugat sau este substituita cu grupe respingatoare de electroni, care maresc energia orbitalului HOMO.
Oxidarea hidrocarburilor, ca alchene si arene, presupune pierderea unui electron si formarea unui radical cation. In functie de conditiile experimentale, radical cationul poate reactiona cu un component nucleofil al mediului sau poate pierde un proton sau o grupa alchil. Oricare din aceste procese conduce la un radical neutru. In general, radicalul este mai usor reductibil deoarece electronul este cedat dintr-un orbital molecular de nelegatura, comparativ cu hidrocarbura initiala unde electronul este cedat dintr-un orbital molecular de legatura. Produsul acestui transfer secundar de electron este un carbocation, care poate participa la diferite procese ulterioare.
Oxidarea electrochimica a alchenelor simple este greu de realizat, are loc la potentiale anodice foarte mari, ce pot fi atinse in acetonitril care contine ca electrolit suport tetraalchilamoniu tetrafluoroborat sau hexafluorofosfat. De exemplu: etena (2,90 V vs. Ag/Ag+ 0,01M), propena (2,84 V), 2-butena (2,26 V). Oxidarea alchenelor pe anozi de aur are loc la potentiale mai mici, interactia alchenelor cu suprafata electrodului de aur faciliteaza oxidarea. Similar, complecsii mercur II – alchene sunt mai usor oxidasi la acizi carboxilici.
Substitutia alilica are loc, cel mai probabil, printr-un intermediar cation alil si este procesul de oxidare electrochimica a alchenelor cel mai frecvent intalnit.
(VII.117)
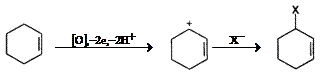
Oxidarea alchenelor devine mai usoara atunci cand sunt substituite cu grupe respingatoare de electroni; substituentii fenil, de asemenea, micsoreaza potentialul de oxidare al legaturii duble. Produsii de oxidare ai arilalchenelor depind de numarul de substituenti aril legati la legatura dubla. In cazul stirenilor si stilbenului, produsii deriva de la radical cationul format intermediar. Atunci cand nucleul aromatic este substituit cu grupe puternic respingatoare de electroni (p-Me2N, p-CH3O) sau alchena este poliaril substituita, este posibila formarea unui dication.
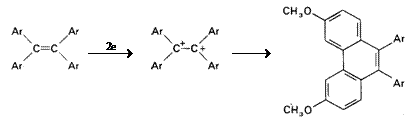
(VII.118)
(Ar = p-CH3OC6H5)
Dicationul tetra-p-anisil-etenei da o reactie de ciclizare intramoleculara cu formarea unor derivati fenantrenici.
O reactie de interes sintetic, raportata de Weingarten si Wilson, este dimerizarea oxidativa a 1,1-bis(dimetilamino)-etenei la derivati butadienici.
(VII.118)
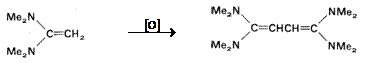
Mecanismul presupune atacul nucleofil al substratului initial asupra radical cationului format intermediar.
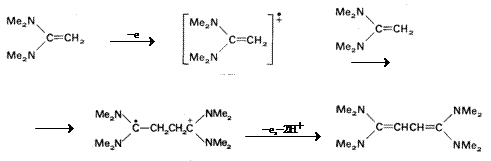
(VII.119)
Legaturile duble >C=C< substituite cu patru heteroatomi respingatori de electroni sunt foarte usor oxidate. Un astfel de exemplu este dat de tetrakis-(dimetilamino)-etena (TDME), care este un agent reducator la fel de puternic ca zincul metalic.
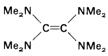
Reactia are loc printr-un transfer bielectronic cu formarea dicationului TDME2+. Diferenta dintre cele doua potentiale de oxidare ( ), corespunzatoare formarii radical cationului si dicationului, poate fi corelata cu constanta de echilibru Kdisp pentru disproportionarea radical cationului in dication si specia neutra initiala,
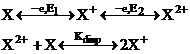
![]()
ΔGo = -RTlnKdisp = -nF(E1-E2)
Pentru TDME, E = +0,14 V in acetonitril la 25oC si Kdisp = 23054.
Au fost studiati si unii enoli, eteri enolici si acetati.
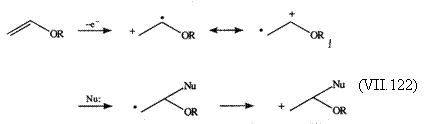
Cedarea unui electron de catre derivatii enolici (1) generaza un radical cation a carui structura de rezonanta cea mai probabila este 2b in care sarcina pozitiva este localizata la atomul de carbon cu grupa alchiloxi. Daca intermediarul 1 pierde un proton, o grupa alchil sau reactioneaza cu un component nucleofil din mediu, conduce la un radical neutru care se oxideaza ulterior la carbocation. Astfel, oxidarea anodica transforma derivatii enolici nucleofili, 1 la cel putin doua specii electrofile puternice 2 si 3.
(VII.123)
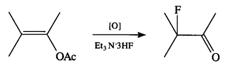
Oxidarea acetatilor
enolici in prezenta ionilor fluorura conduce la -fluorocetone.
Pot avea loc doua procese: atacul nucleofil al ionilor fluorura si dezacetilarea, care implica atacul nucleofil la F- asupra grupei carbonil.
(VII.124)
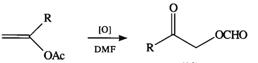
Oxidarea anodica a
acetatilor vinilici in dimetilformamida conduce la -formiloxi
cetone.
Grupa formiloxicarbonil provine din solvent, DMF.
In cazul reducerii electrochimice, speciile rezultate (radical neutru in mediu acid sau radical anion in mediu neutru, alcalin sau aprotic) depind de o serie de factori ca: pH, impedimente sterice, potential de reducere. Datorita delocalizarii extinse, radicalii sistemelor dau frecvent reactii la mai multe centre active. Mai mult decat atat, intr-o prima etapa electrochimica este posibil din punct de vedere energetic transferul concertat de electroni a doua molecule de substrat cu formarea unui intermediar dimeric.
Alchenele activate sunt compusi care contin o legatura dubla la care este atasat orice substituent electronegativ capabil sa realizeze o conjugare.
(VII.125)
![]()
Reducerea unor astfel de compusi, in general, conduce la produsi cu formula 1. aceasta reactie cu formarea de legatura carbon – carbon este cunoscuta ca hidrodimerizare.
Anumite cetone -nesaturate ciclice si aciclice prezinta, in mediu acid, o singura unda polarografica. Pe masura ce pH-ul creste, intensitatea undei scade, apare o a doua unda la potentiale mai negative si se aplatizeaza odata cu cresterea pH-ului. In medii alcaline este observata doar cea de-a doua unda polarografica. Potentialul de semiunda al primei unde este pH dependenta; cel de-al doilea nu. Prima unda este datorata reducerii acidului conjugat al cetonei. De exemplu, pentru metil vinil cetona, pe catod de mercur, in mediu acid (pH < 5) se obtine un compus al mercurului, cu randamente foarte bune.
Reactia de hidrodimerizare in medii slab alcaline si neutre prezinta un mecanism complex. Acetonitrilul prezinta o unda polarografica bielectronica, sugerand un mecanism ECE, cu formarea de propionitril.
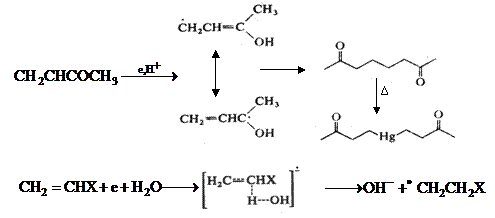
![]() , X = CN
, X = CN
Fig. 7.17 Reactia de hidrodimerizare a metilvinil cetonei.
Beck a demonstrat participarea unei molecule de apa in etapa determinanta de viteza, iar transferurile de electron si proton sunt concertate.
Surprinzator, principalul produs de electroliza a acetonitrilului nu este propionitrilul ci adiponitrilul;
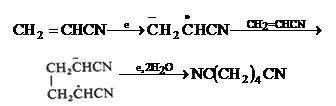
(VII.126)
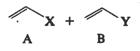
Baizer si colab.
au aratat ca reactia de hidrodimerizare se poate realiza ca o
cuplare mixta a doua alchene activate diferite. In principiu, astfel
de reduceri formeaza trei produsi diferiti:
![]()
![]()
(VII.127)
Daca A se reduce mai usor decat B ( < 0,2 V) si electroliza are loc la potentialul de reducere al lui A, atunci se obtin doar produsii A-A si A-B.
Prin reducerea alchenelor activate in solventi aprotici se formeaza polimeri.
2 Electrochimia legaturii >C=O
Oxidarea electrochimica a legaturii >C=O este rar observata, deoarece majoritatea sistemelor electrod-electrolit sunt mai usor oxidabile decat grupa carbonil in sine. Manousek si Volke au raportat oxidarea anodica directa a aldehidelor aromatice pe electrod de mercur; in realitate oxidarea este datorata oxizilor sau hidroxizilor de mercur corespunzatori formati datorita oxidarii electrodului.
Exista studii recente privind transformarea electrochimica a cetonelor prin generarea anodica a unor specii pozitive de halogenura. Oxidarea ionilor halogenura produce agenti de halogenare care reactioneaza cu compusii carbonilici formand derivati halogenati. Exemple recente includ conversia anodica a metil cetonelor la metil esteri, in MeOH/NaBr (reactia electrochimica haloforma), sau conversia anodica a cetonelor in epoxinitrili in prezenta cianurii de sodiu si iodurii de potasiu.

Oxidarea anodica a unui amestec de aldehida si ester activat, in acetonitril apos cu un continut de azotat de litiu, are loc prin aditia a doua grupe acil la legatura dubla carbon - carbon.
![]()
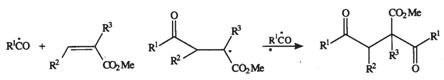
(VII.129)
(VII.130)
Miller si colab. au raportat un proces interesant de fragmentare oxidativa a aldehidelor si cetonelor benzilice pe electrod de platina, in acetonitril. Oxidarea are loc cu ruperea legaturii C – C, iar produsii de oxidare pentru astfel de oxidari sunt prezenti in tabelul urmator:
|
Compus |
Potential, V vs Ag/AgNO3 |
produs |
|
(C6H5)2CHCOC6H5 |
(C6H5)2CO (C6H5)2COOH |
|
|
(C6H5)2CHCHO |
(C6H5)2CO (C6H5)2CHNHCOCH3 |
|
|
C6H5CH2COC6H5 |
C6H5COOH C6H5COCOC6H5 C6H5CHO |
|
|
C6H5CH(CH3)CHO |
C6H5CH(CH3)NHCOCH3 C6H5COCH3 |
|
|
C6H5CH(OH)COC6H5 |
C6H5CHO C6H5COOH C6H5COCOC6H5 |
|
|
(C6H5)2CHOH |
(C6H5)2CO (C6H5)2CHOCH(C6H5)2 |
De exemplu, mecanismul de oxidare pentru benzoin este reprezentat astfel:
![]()
![]() (VII.131)
(VII.131)
![]() (VII.132)
(VII.132)
![]() (VII.133)
(VII.133)
Un mecanism de oxidare mult mai complex este intalnit in cazul in care unul sau mai multi produsi sunt, la randul lor, oxidabili. Pentru cetona discutata, prin oxidare se formeaza benzhidrol si acid benzoic. Benzhidrolul se oxideaza la 1,7 V, in timp ce substratul initial nu se oxideaza la potentiale mai mici de 1,8 V. In consecinta, benzhidrolul se oxideaza rapid pe masura ce se formeaza.
Schema urmatoare sistematizeaza procesele de oxidare pentru benzhidril fenil cetona.
![]() (VII.134)
(VII.134)
(VII.135)
![]()
![]() (VII.136)
(VII.136)
Diaril cetonele,
asa cum este benzofenona, prezinta un comportament electrochimic
asemanator hidrocarburilor aromatice. In mediu acid, benzofenona se
reduce in doua trepte monoelectronice succesive. Intr-o prima
etapa, are loc reducerea grupei carbonil protonate la un radical, 1, iar
ulterior, acest radical se reduce la un carbanion:![]() (VII.137)
(VII.137)
![]() (VII.138)
(VII.138)
La pH = 1,3, benzofenona formeaza benzpinacolona (3) cu randamente ridicate.
![]() (VII.139)
(VII.139)
![]()
(VII.140)
La valori mai mici ale pH-ului, doar o fractie mica a moleculelor de benzofenona este protonata. S-a observat ca cetona difuzeaza in stare neutra catre electrod, este polarizata si protonata in campul electric de la suprafata electrodului. Dependenta de pH indica prezenta protonilor in starea de tranzitie.
In medii neutre sau slab bazice (4,9 ≤ pH ≤ 11,3) benzofenona prezinta o singura unda polarografica bielectronica. In acest domeniu de pH, specia electroactiva este cetona neutra; se reduce la radical anion, 4 si accepta imediat un proton de la solvent. Radicalul rezultat se reduce;
![]() (VII.141)
(VII.141)
La pH = 4,9 se formeaza cantitati comparabile de benzhidrol si benzpinacol. La pH = 8,6 benzpinacolul se obtine in cantitati de urme. Acest lucru se explica prin faptul ca la valori din ce in ce mai mari ale pH-ului, viteza de dimerizare a 1 este suficient de mare si intra in competitie cu transferul de electron. Astfel, se poate evita formarea pinacolului conducand electroliza la potentiale foarte negative, unde transferul de electron este foarte rapid, sau prin folosirea unei solutii foarte diluate de cetona.
In medii aprotice sau puternic alcaline, radical anionul, 4 format intermediar nu se protoneaza si este redus la dianion. Reactiile speciei 4 cu iodura de etil sau dioxidul de carbon initiaza o secventa ECE;
![]()
![]()
![]()
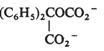
![]()
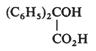
![]()
![]()
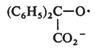
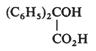
Fig. 7.18 Mecanismul de reducere
electrochimica a benzofenonei.
Acizii carboxilici aromatici si derivatii lor sunt reductibili la potentiale foarte negative. Procesul implica reducerea la o aldehida, care in functie de conditiile experimentale poate fi redusa ulterior sau nu. Astfel, anumite amide si acizi heterociclici sunt redusi la aldehide deoarece gruparea carbonil se hidrateaza rapid cu formarea unei specii electroinactive.
(VII.142)
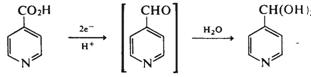
Acizii aromatici se reduc la alcooli deoarece aldehidele corespunzatoare nu sunt protejate prin hidratare.
![]() (VII.143)
(VII.143)
In medii neutre, oximele pot fi transformate electrochimic in amine.
![]() (VII.144)
(VII.144)
(VII.145)
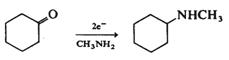
Acesta este un procedeu
eficient de aminare reductiva a aldehidelor si cetonelor. De exemplu,
prin reducerea ciclohexanonei in EtOH/MeNH2 sau in MeNH2
se formeaza metil ciclohexil amina.
3 Electrochimia legaturii >C=NH
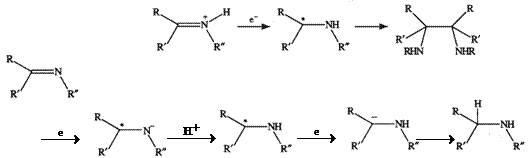
Comportamenul electrochimic al compusilor care contin grupa azometin este asemanator celui coresaunzator compusilor carbonilici cu deosebirea ca azometinii sunt mai usor reductibili decat compusii carbonilici. S-a observat ca o solutia care contine o amina primara si un compus carbonilic se poate reduce in conditii in care niciunul din cei doi compusi nu se pot reduce individual. Electroactivitatea este atribuita produsului de condensare – un azometin. Condensarea este o metoda practica de transformare a unui compus carbonilic electroinactiv intr-o specie activa electrochimic.
Comportamenul electrochimic al iminelor R2R = NR depinde de gradul de arilare. Iminele complet substituite cu radicali aril, ca arilbenzofenona (Ph2C=NPh) sunt usor reduse prin intermediari relativ stabili. Odata cu inlocuirea grupelor aril cu hidrogen sau grupe alchil, atat usurinta reducerii cat si stabilitatea produsilor scad.
O importanta foarte mare o are si pH-ul solutiei. Diaril iminele de tipul Ar2C=NR si ArRC=NAr se reduc la pH = 13 spre deosebire de triaril imine care se reduc la pH = 9. acest comportament este explicat pe baza bazicitatii foarte mari a iminelor complet arilate. Deoarece hidrolizeaza rapid in mediu acid, comportamentul electrochimic poate fi studiat numai la pH-uri ≥ 7.
Monoaril si trialchiliminele se reduc prin procese electrodice bielectronice, in medii protice, la amine secundare. In medii aprotice, trialchiliminele nu sunt reductibile, sugerand ca si in cazul cetonelor, ca in solventi protici reducerea este favorizata de prezenta hidrogenului din solvent.
Diariliminele si sarurile de iminiu, in anumite conditii, formeaza diamine vicinale. De exemplu, benzol-p-toluidina conduce la un amestec de dl si mezo izomeri (solvent – etanol, electrozi de cupru).
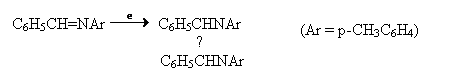
Reducerea
electrochimica a iminelor in mediu acid are loc prin specii de iminiu.
![]()
Fig. 7.19 Mecanismul de reducerea electrochimica a iminelor
in mediu acid.
Deoarece speciile de iminiu au sarcina pozitiva sunt mai usor de redus; rezulta un radical neutru la potentiale mai pozitive decat potentialul sau de reducere. Produsii formati deriva de la radicalul neutru si nu de la carbanionul intermediar.
Andrieux si Saveant au redus sarurile de iminiu in solventi aprotici anhidri si au obtinut diamine vicinale prin intermediari radicalici.
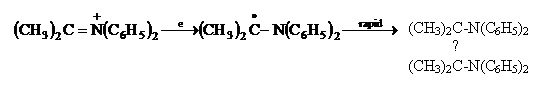
![]()
(VII.146)
Benzalanilinele prezinta un comportament asemanator monoaril iminelor. Studii de voltametrie ciclica si spectroscopie ERS au aratat ca stabilitatea radical anionului format initial depinde de natura celor doua grupe aril.
![]()
(VII.147)
Compusii de tipul R2C = NX (X = N sau O) sunt redusi prin procese tetraelectronice. Initial are loc scindarea legaturii N-X urmata de reducerea intermediarului iminic la amina.
Compusii care contin grupa functionala >C=NH participa mult mai usor la procese de oxidare atunci cand atomul de azot este substituit cu un heteroatom. Cei mai simpli astfel compusi sunt oximele si se oxideaza anodic la nitril oxizi, daca procesul are loc intr-o celula necompartimentata, intermediarul (nitril oxid) se reduce catodic la nitril.
![]()
(VII.148)
Diaril, arilalchil si dialchil oximele, in mediu acid, se reduc intr-o singura etapa tetraelectronica,
R2C=NOH + 5H+ + 4ē → R2CHNH3+ + H2O (VII.149)
Reducerea implica acidul conjugat al oximei cu scindarea initiala a legaturii N-O, formarea unei oxime urmata de protonare si reducere.
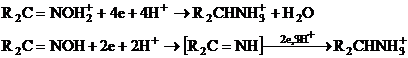
![]()
Hidroxiaminele nu sunt reductibile la potentialele de reducere a oximelor la amine.
Anumite oxime prezinta doua tipuri de reducere bielectronica. In aceste cazuri, electroliza la potential constant conduce initial la formarea unei imine. La pH ~ 6, unda polarografica observata in mediu acid dispare si apare o unda tetraelectronica corespunzatoare reducerii oximei neutre la potentiale multe mai negative. In medii puternic bazice, bazele conjugate ale oximelor nu sunt reductibile.
In medii acide, fenilhidrazonele si semicarbazonele sunt reduse intr-o singura etapa la amine,
![]() , X = Ph, CONH2
, X = Ph, CONH2
(VII.152)
In conditii neutre, oximele pot fi transformate electrochimic la amine.
![]() (VII.153)
(VII.153)
Aceasta reactie este o metoda eficienta de aminare reductiva a aldehidelor si cetonelor. Procesul decurge cu randamente mari si fara reactii secundare. Similar, se pot obtine amine secundare prin condensarea compusilor carbonilici cu amine primare si reducerea iminelor formate intermediar. Anumite procese de transformare a cetonelor la amine se pot realiza fara izolarea intermediarilor iminici deoarece iminele se reduc la potentiale mai usor accesibile decat compusii carbonilici.
Conditiile generale de reducere electrochimica a iminelor la amine respectiv diamine vicinale, depind de gradul de arilare si sunt prezentate in tabelul urmator:
|
Tipul de imina |
Amine |
Diamine vicinale |
|
Triaril |
Alcalii apoase, pH 10-12 |
Alcalii apoase, pH≥13 Etanol anhidru DMF cu donori de protoni (fenol etc.) |
|
Diaril |
Alcalii apoase, pH≥12 DMF cu acizi slabi (fenol etc.) |
Alcalii apoase, pH 7-11 Etanol anhidru DMF cu acizi tari (HCl etc.) Etanol:acetat de metil:apa (5:3:1), 65oC |
|
Monoalchil |
Etanol anhidru DMF Etanol:acetat de metil:apa (5:3:1), -10oC |
Etanol anhidru DMF cu donori de protoni (fenol etc.) Etanol:acetat de metil:apa (5:3:1), 65oC |
|
Trialchil |
Etanol neutru Etanol anhidru DMF cu donori de protoni (fenol etc.) |
Etanol anhidru DMF cu donori de protoni (fenol etc.) |
4 Electrochimia legaturii -N=N-
Acest subcapitol se refera la oxidarea si reducerea electrochimica a compusilor diazo (R2CN2) si a sarurilor de diazoniu (R2N2+X-), unde R poate fi alchil, aril sau hidrogen. Compusii diazo pot fi atat oxidati cat si redusi electrochimic, in timp ce sarurile de diazoniu, datorita sarcinii pozitive, nu pot fi oxidate electrochimic.
Oxidarea anodica a compusilor diazo (diazo, ArCN2Ar`, diazocarbonilici, ArCN2COAr` si diazocarboxilici ArCN2COOEt) are loc prin formarea intermediara a unui radical cation;
Initiere ![]() (VII.154)
(VII.154)
1 2
Propagare
![]() (VII.155)
(VII.155)
3
![]() (VII.156) 4
(VII.156) 4
Intrerupere
![]() (VII.157)
(VII.157)
5
![]() (VII.158)
(VII.158)
![]()
(VII.159)
Radical cationii formati prin oxidarea compusilor diazo se descompun printr-un mecanism foarte complex. In exemplul prezentat, din diazodifenil metan, 4, produsul principal (η = 80%) este tetrafeniletena, 4, dar se obtin si cantitati mici de benzofenona, benzpinacolona si benzhidrol.
Spre deosebire de compusii arildiazo, unde cuplarea intermediarului se realizeaza la atomul de carbon diazo, in cazul compusilor diazocarbonilici cuplarea se face in pozitiile para ale nucleelor benzenice.
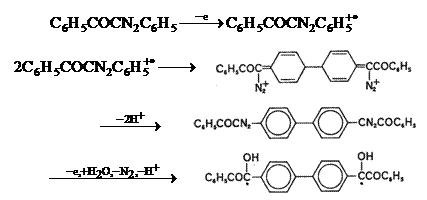
Fig. 7.20 Mecanismul de cuplarea para compusilor diazocarbonilici.
Transformarea anodica a grupei diazo la un radical n-hidroxicarbonil poate fi explicata prin urmatorul mecanism:
(VII.160)
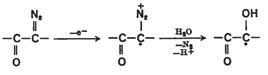
![]() Elofson si colab.
au obtinut perclorat de N-metil piridiniu prin oxidarea
electrochimica a diazometanului in prezenta piridinei (solvent –
sulfolan).
Elofson si colab.
au obtinut perclorat de N-metil piridiniu prin oxidarea
electrochimica a diazometanului in prezenta piridinei (solvent –
sulfolan).
(VII.161)
Autorii au considerat ca mecanismul implica generarea succesiva a radical cationului diazometan, radical cationului metilen si in final a cationului metil.
![]() N- metilpiridina
N- metilpiridina
(VII.162)
Majoritatea studiilor privind reducerea electrochimica a compusilor diazo au fost realizate folosind derivati diazocarbonilici.
RCOCN2 C6H5COCHN2 │ R`
Reducerea electrochimica a derivatilor diazocarbonilici este usor inteleasa prin referirea la diazoacetofenona. Acest compus prezinta trei unde polarografice de reducere in solutie tampon, la pH = 6. Reducerile succesive corespund acceptarii de 6, 2 si respectiv 2 electroni cu formarea de -aminoacetofenona, acetofenona si in final -fenil etanol.
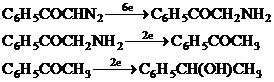
Prima etapa de reducere a diazoacetofenonei la -aminoacetofenona implica acceptarea a 6 electroni si 6 protoni. Astfel, se pot realiza o serie de etape succesive cu transfer de electroni si protoni in cadrul unui mecanism foarte complex;
![]()
![]()
![]()
![]()
![]()
![]()
Fig. 7.21 Mecansimul de reducere electrochimica a diazoacetofenonei.
La reducerea electrochimica a diazodifenilmetanului se obtin difenilmetan (20%), benzhidrilamina (20%) si cantitati mici de azodifenilmetan. Formarea acestor produsi este explicata pe baza urmatorului mecanism:
![]()
![]()
![]()
![]()
![]()
Fig. 7.22 Mecansimul de reducere electrochimica a diazodifenilmetanului.
Asa cum arata si acest mecanism, comportamentul electrochimic al compusilor diazo in medii aprotice difera de cel considerat in medii protice.
Intr-un mod asemanator se comporta si azoderivatii. Azobenzenul este redus electrochimic la hidrazobenzen in domeniul de pH 2-6.
![]() (VII.166)
(VII.166)
La pH ≤ 2 are loc reducerea ulterioara a hidrazobenzenului la anilina, dar potentialul de lucru trebuie sa fie mai negativ decat cel al formarii hidrazobenzenului.
![]() (VII.167)
(VII.167)
Daca electroliza are loc la valori foarte mici ale pH-ului si potentiale necesare reducerii azobenzenului si nu hidrazobenzenului, atunci se formeaza benzidina printr-un rearanjament in cataliza acida a hidrazobenzenului.
![]() (VII.168)
(VII.168)
Astfel, prin alegerea convenabila a pH-ului si a potentialului este posibila transformarea azobenzenului in hidrazobenzen, benzidina sau anilina.
Un mecanism mai complex a fost observat in cazul in care nucleul aromatic este substituit cu grupe respingatoare de electroni.
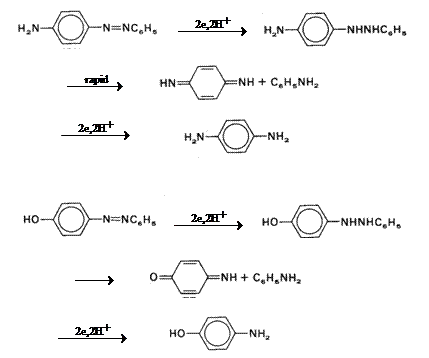
Fig. 7.23 Mecansimele de reducere electrochimica a azobenzenului
si p-hidroxi azobenzenului.
|