Interceptarea intermediarilor
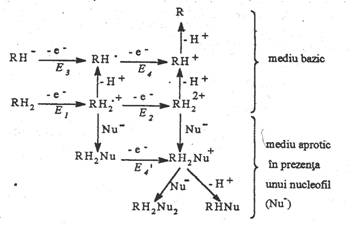
Pentru a realiza o anumita transformare, sunt posibile mai multe mecanisme, asa cum se poate observa in figura

Fig. 7.3 Mecanisme
de reactie posibile pentru reducerea (oxidarea) unei substante A (AH2).
In aceasta schema t 424j91e ransferurile de electroni sunt reprezentate prin sageti orizontale (E) iar reactiile chimice (protonari si deprotonari) prin sageti verticale (C).
Exista 6 posibilitati de reactie: CCEE, CECE, CEEC, ECCE, ECEC, EECC. Analiza acestora arata ca mecanismul de reactie va depinde de constantele echilibrelor acido-bazice si de constantele de viteza ale transferurilor de sarcina. La un anumit potential sunt posibile mai multe cai de reactie. De asemenea, mecanismul de reactie pentru procesul de reducere (A + 2ē + 2H+ → AH2) poate fi diferit de cel de oxidare (AH2 → A + 2ē + 2H+).
1 Intermediari in reactiile de oxidare
Pentru oxidarea unui
substrat (molecula neutra sau anion) se poate considera
urmatoarea figura:
Fig. 7.4 Mecanismele de oxidare a unei molecule neutre sau a unui anion.
Reactiile chimice cuplate transferurilor de electroni pot fi reactii de deprotonare )favorizate de prezenta bazelor si incetinite de acizi) sau reactii de aditie ale reactantilor nucleofili.
Ordinea potentialelor E2 > E1 > E3 > E4 sau E4` se explica prin faptul ca in raport cu oxidarea unei molecule, un cation este mai greu de oxidat, iar un radical sau anion sunt mai usor oxidabili.
2 Intermediari in reactiile de reducere
Pentru reducerea unui substrat organic cu 2 electroni se poate considera figura 7.5 de reducere a lui R la specii reduse:
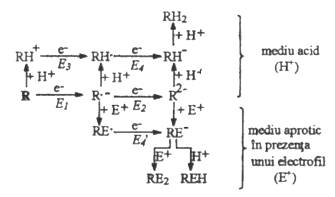
Fig. 7.5 Mecanismele de reducere a unei molecule neutre sau a unui cation.
Reactiile chimice pot fi de protonare (posibile intr-un mediu protic) sau aditii de agenti electrofili (posibile intr-un mediu aprotic).
In privinta potentialelor de reducere se pot face urmatoarele observatii:
E1 > E2, deoarece un anion este intotdeauna mai greu de redus decat specia neutra corespunzatoare,
E1 < E3, deoarece un cation este mai usor de redus decat o molecula neutra,
E1 < E4, E1 < E4`, deoarece un radical se reduce mai usor decat o molecula,
E3 si E4 sunt de acelasi ordin de marime, iar valorile lor depind de aciditatea solutiei.
Caracterul protic al mediului
Majoritatea investigatiilor electrochimice ale substantelor organice au loc in solventi protici ca apa, etanol sau dioxan in solutie apoasa deoarece conductivitatea acestora este relativ mare; chiar si in acesti solventi caile proceselor de electrod difera in functie de caracterul acid, neutru sau bazic al mediului de reactie. Rolul donorilor de protoni prezenti in mediu este usor de studiat prin folosirea unor solventi aprotici (dimetilformamida, DMF, acetonitril, AN, dimetilsulfoxid, DMSO) si introducerea unor cantitati cunoscute si crescatoare de donori de protoni (fenol sau acid benzoic).
Hoijtink a observat prima data acest comportament la reducerea hidrocarburilor aromatice in dioxan cu un continut de apa de la 4 la 25% (figura 7.6). El explica fenomenul prin urmatoarea figura:
![]()
![]()
![]()
![]()
![]()
![]()
Fig. 7.6 Reducerea electrochimica a hidrocarburilor aromatice
in dioxan cu urme de apa.
- in solventi aprotici
ca dioxan 96% sau etanol in mediu bazic, radical anionul, ![]() format la
potentialul E1 este protonat si difuzeaza spre
interiorul solutiei. In acest caz se observa o
a doua unda monoelectronica corespunzatoare reducerii la dianion
R2-, la potentialul E3.
format la
potentialul E1 este protonat si difuzeaza spre
interiorul solutiei. In acest caz se observa o
a doua unda monoelectronica corespunzatoare reducerii la dianion
R2-, la potentialul E3.

Fig. 7.7 Reducerea electrochimica a hidrocarburilor aromatice
in dioxan 96%.
- in solventi protici ca dioxan 75%, etanol in mediu neutru sau DMF
cu adaos de fenol, radical anionul, ![]() este protonat rapid cu
formarea unui radical liber RH..
este protonat rapid cu
formarea unui radical liber RH..
Hoijtink a aratat prin calcule ca radicalul RH., in general, este mai usor de redus decat substratul initial, R la un potential E2 mai mare decat E1.
Deoarece RH.
se formeaza prin protonare la potentialul E2, in
solventi protici este redus rapid pe masura ce este format.
Chiar si in solventi protici exista posibilitatea ca radical
anionul, ![]() cu reactivitate mare,
sa participe mult mai rapid la alte reactii ca disproportionare
sau dimerizare.
cu reactivitate mare,
sa participe mult mai rapid la alte reactii ca disproportionare
sau dimerizare.
In mediu puternic acid, substratul organic initial este protonat, iar specia electroactiva este acidul conjugat RH+ (sau echivalent, un complex intre R si HX). Datorita sarcinii pozitive, potentialul de reducere, E4 este mai pozitiv decat E1 si chiar E2.
Hidrocarburile aromatice nu sunt suficient de bazice pentru a prezenta un astfel de comportament, dar a fost observat in cazul unor substraturi cu unu sau mai multi heteroatomi ca cetone aromatice si baze Schiff.
4 Agenti de captare
In general, este posibila interceptarea intermediarilor generati electrochimic atunci cand agentii de captare 1) nu reactioneaza cu specia electroactiva inainte de transferul de electroni sau 2) atunci cand agentul de captare este inert electrochimic la potentialul de electroliza. Un exemplu il constituie adaugarea donorilor de protoni in solventi aprotici. Se pot adauga alti agenti pentru stabilizarea speciilor generate electrochimic cu reactivitate mare, pentru modificarea caii de reactie sau demonstrarea mecanismelor cu punerea in evidenta a intermediarilor prin interceptarea lor.
Wawzonek si coautorii au demonstrat prezenta intermediarilor carbanionici la reducerea electrochimica a difenilacetilenei in solventi aprotici prin barbotarea de CO2 si izolarea anhidridei difenilmaleice, 1, acidului difenilfumaric, 2 si acidului mezo-difenilsuccinic, 3. Autorii au propus urmatorul mecanism de reactie:

![]()
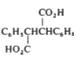
1 2 3
![]() 5
5
![]() +
+
![]() 6
6
![]()
![]()
![]()
![]()
![]()
![]()
Fig. 7.8 Mecanismul reducerii electrochimice a difenilacetilenei
in solventi aprotici.
Dianionii 5 si 6 sunt respectiv precursorii pentru 1 si 2, iar 3 se obtine prin reducerea lui 1 sau 2. In DMF, acetilena prezinta doua unde polarografice, in timp ce formarea speciilor 5 sau 6 necesita o reducere la potentialul celei de-a doua unde. Din nefericire, electroliza a fost condusa la curent constant, astfel ca formarea dianionilor nu poate fi exclusa. Luand in considerare rolul donorilor de protoni in interceptarea radical anionilor, autorii au propus urmatorul mecanism ECE, mult mai probabil:

![]()
![]()
![]()
7a 7b
![]()
![]()
![]()
![]()
![]()
![]()
Fig. 7.9 Mecanismul reducerii electrochimice a difenilacetilenei in DMF.
Izolarea compusilor 1 si 2 in acelasi raport (1:2,3) in conditiile unei electrolize la curent constant vine in favoarea mecanismului ECE.
5 Reactivi generati electrochimic
Interceptarea intermediarilor organici poate fi realizata prin generarea electrochimica in situ a unor reactivi, de obicei anorganici, care reactioneaza cu substratul organic de analizat. De exemplu, oxidarea electrochimica a hidrocarburilor aromatice in prezenta unor ioni ca cianura, metoxi si hidroxi duc la o substitutie a nucleului aromat.
![]() (X - anion) (VII.18)
(X - anion) (VII.18)
In etapa electrochimica initiala a procesului de oxidare poate participa atat anionul cat si specia aromatica:
![]() (VII.19)
(VII.19)
sau
![]() , X2 sau X+
, X2 sau X+![]() produsi (VII.20)
produsi (VII.20)
Din aceasta categorie face parte si reducerea legaturii triple pe un electrod de nichel spongios in solventi protici.
RC≡CR + 2ē + 2H+ → cis-RCH═CHR (VII.21)
Reducerea substratului organic se face de catre hidrogenul generat electrochimic, electrodul servind drept catalizator.
Exista o serie de alti reactivi generati electrochimic in situ (Cl2, Br2, I2, Fe2+, H+, OH-= care printr-un control riguros al curentului se poate obtine in concentratii foarte mici, de ordinul 10-6-10-7 M.
Din punct de vedere sintetic, cel mai interesant reactiv generat electrochimic este electronul solvatat. Benkeser si coautorii au realizat reducerea unor grupe functionale (nuclee aromatice, acetilene, compusi carbonilici, imine etc.) de catre electroni solvatati generati electrochimic prin electroliza unei solutii de clorura de litiu pe catod de platina in amine cu temperaturi de fierbere mici. Procedeul necesita cantitati foarte mici de litiu;
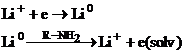
![]()
Benkeser si Kaiser au separat spatiul anodic de cel catodic printr-o membrana semipermeabila in timpul reducerii benzenului. Aceasta membrana impiedica protonii generati la anod prin oxidarea solventului sa reactioneze cu carbanionii formati la catod. Ca o consecinta, in compartimentul catodic se pastreaza un mediu bazic puternic, iar produsii formati initial se pot izomeriza si reduce in continuare la tetraderivat.
|