Ionizarea acizilor si bazelor. Se considera reactia de ionizare care are loc la dizolvarea unui acid slab HA in apa: HA + H2O H3O+ + A-
Aplicand legea
actiunii maselor se obtine constanta
de echilibru K a reactiei reversibile: 
in care concentratiile componentilor amestecului la echilibru, exprimate in moli/litru sunt cuprinse in paranteze.
Pentru solutii diluate, se
aproximeaza concentratia apei ca fiind constanta in sensul
ca prea putina apa s-a consumat in reactia cu acidul,
deci poate fi trecuta in membrul stang al egalitatii si
inclusa in valoarea constantei de echilibru, incat relatia devine: 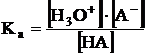 sau
sau 
Noua constanta Ka, numita constanta de aciditate sau de ionizare acida, este o masura a tariei acizilor slabi. Pentru simplitate, se va folosi in continuare H+ in loc de H3O+ reamintind ca nu exista proton liber in solutie, ci numai sub forma H3O+ .
Valoarea constantei
termodinamice de aciditate este: 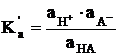
notand prin a activitatile. Deoarece a =
f·c, unde f este coeficientul de activitate, relatia devine: ![]() Pentru
solutiile diluate de acizi slabi, coeficientul de activitate al
moleculelor neionizate fHA este egal cu 1, incat relatia
devine: Ka` = Kc·fH+·fA-
= Kc·f2
Pentru
solutiile diluate de acizi slabi, coeficientul de activitate al
moleculelor neionizate fHA este egal cu 1, incat relatia
devine: Ka` = Kc·fH+·fA-
= Kc·f2
in care f reprezinta coeficientul mediu de activitate.
Spre deosebire de bazele tari, care sunt, ca si sarurile, alcatuite din ioni, bazele slabe sunt alcatuite din molecule. La dizolvare, ele reactioneaza cu apa ionizandu-se dupa o reactie asemanatoare cu cea a amoniacului:
![]() NH3 + H2O
NH4+ + HO-
NH3 + H2O
NH4+ + HO-
Aceste reactii
sunt reversibile si au echilibrul mult deplasat spre stanga. Aplicand
legea actiunii maselor ca si in cazul acizilor slabi, se obtine
constanta de ionizare bazica (constanta de bazicitate) Kb: 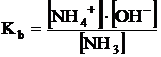
Ca si in cazul acizilor slabi, constanta de bazicitate este o masura a tariei bazelor slabe.
Acizii cu doi protoni se numesc diprotici (H2S si acidul oxalic HOOC-COOH), cu trei protoni triprotici (H3PO4 si acidul citric), etc. dupa numarul de protoni pe care pot sa-i cedeze bazelor. Ionizarea acestor acizi se face in trepte succesive, in prima treapta avand loc o ionizare puternica, iar in celelalte trepte ionizarea decurgand mult mai slab. De aceea, prima constanta de ionizare (constanta partiala) este mult mai mare decat a doua, a doua constanta mai mare decat a treia, etc. (K1 > K2 > K3 > Kn). Intre prima si a doua treapta de ionizare exista o diferenta valorica mare (K1:K2 = 105) deoarece, in urma cedarii unui proton, acidul capata o sarcina negativa care tine mai strans urmatorul proton ce urmeaza a fi disociat. De exemplu, in cazul H3PO4 ionizarea decurge in urmatoarele trei trepte, taria acidului in fiecare treapta fiind data de valorile constantelor partiale de aciditate:
![]() H3PO4
+ H2O H3O+ +
H2PO4- ; K1=7,5·10-3
H3PO4
+ H2O H3O+ +
H2PO4- ; K1=7,5·10-3
![]() H2PO4-
+ H2O H3O+ +
HPO42- ; K2=6,2·10-8
H2PO4-
+ H2O H3O+ +
HPO42- ; K2=6,2·10-8
![]() HPO42-
+ H2O H3O+ +
PO43- ; K3=4,8·10-13
HPO42-
+ H2O H3O+ +
PO43- ; K3=4,8·10-13
Ultimele trepte de disociere apar numai in solutii mai diluate, in timp ce primele in solutii mai concentrate. In cazul acizilor poliprotici organici, valoarea constantelor partiale de disociere sunt in stransa legatura si cu structura spatiala a moleculei. Aceleasi consideratii se pot face si pentru baze.
Legea dilutiei. Se ia in considerare un electrolit slab oarecare, de exemplu CH3COOH, in solutie, al carui grad de ionizare este si c concentratia molara.
Concentratia ionilor rezultati prin ionizare va fi egala cu ·c, iar concentratia moleculelor ramase neionizate va fi (1-)c:
![]() CH3COOH H+
+ CH3COO-
CH3COOH H+
+ CH3COO-
![]() (1-)c c + c
(1-)c c + c
Facand inlocuirile in relatia ce da valoarea constantei de ionizare, se obtine:
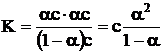
Aceasta relatie numita legea dilutiei a lui Wilhelm Ostwald (1888) stabileste legatura dintre constanta de ionizare, gradul de ionizare si concentratia solutiei. In cazul electrolitilor foarte slabi, ( foarte mic) de la numitor se poate neglija, incat 1- 1, deci relatia devine:
K = 2c iar ![]() Din relatia de mai sus,
rezulta ca gradul de disociere
este invers proportial cu radacina patrata a
concentratiei. Daca se inlocuieste c cu 1/V, adica
dilutia (V este volumul in care se afla dizolvat un mol de
substanta), relatia devine:
Din relatia de mai sus,
rezulta ca gradul de disociere
este invers proportial cu radacina patrata a
concentratiei. Daca se inlocuieste c cu 1/V, adica
dilutia (V este volumul in care se afla dizolvat un mol de
substanta), relatia devine:
![]()
de unde rezulta ca gradul de ionizare creste cu radacina patrata a dilutiei.
Pentru exprimarea tariei acizilor si bazelor slabe, se utilizeaza in mod curent constanta de ionizare care ramane practic aceeasi la diferite concentratii, in timp ce gradul de ionizare creste cu dilutia.
|