Caracteristicile legaturii ionice:
este de natura fizica si consta în atractia preponderent electrostatica dintre ioni;
nu este orientata în spatiu, ionii încarcati uniform cu electricitate, pot atrage, din orice directie , ioni de semn contrar, pen 121g65b tru a forma un edificiu cristalin (asa se explica dizolvarea combinatiilor ionice în solventi polari si izomorfismul);
este nesaturata, un ion se înconjoara cu un numar maxim de ioni de semn contrar, care se dispun la distanta de echilibru r = r++r- permisa de egalarea fortelor atractive cu cele repulsive;
numarul de coordinatie depinde de raportul r+/r- ;
este puternica în cadrul distantelor interionice din retelele cristaline si slabeste cu cresterea acestor distante;
Prin combinare chimica atomii tind sa-si modifice nivelul electronic exterior (de valenta) astfel încât sa realizeze o configuratie electronica de octet cât mai stabila corespunzatoare unui gaz rar (ns2np6). Tendinta de a dobândi astfel de configuratii se datoreste configuratiei electronice periferice nestabile a atomilor izolati si explica întocmai reactivitatea acestora.
Atomii elsementelor din grupele I si II A pierd usor electronii excedentari si devin ioni pozitivi sau cationi: ex.
![]() 11Na-1e- 11Na+
11Na-1e- 11Na+
![]() 1s22s22p63s1 -1e- 1s22s22p6,
configuratie [10Ne]
1s22s22p63s1 -1e- 1s22s22p6,
configuratie [10Ne]
Atomii din grupele VII, VI A accepta unul sau doi electroni în stratul exterior, completându-si octetul si devin ioni negativi sau anioni: ex.
![]() 17Cl+1e- 17Cl-
17Cl+1e- 17Cl-
![]() 1s22s22p63s23p5
+1e- 1s22s22p63s23p6,
configuratie [17Ar]
1s22s22p63s23p5
+1e- 1s22s22p63s23p6,
configuratie [17Ar]
Ionii formati în acest mod nu ramân izolati, ci se atrag prin forte electrostatice pâna la o anumita distanta minima la care încep sa se exercite fortele repulsive dintre învelisurile electronice.
Reactia chimica dintre un metal alcalin si un halogen conduce la o combinatie ionica formata prin transfer de electroni de la elementul electropozitiv la cel electronegativ.
![]() Na. + Cl .
Na. + Cl .![]() Na+[ Cl ]- (electr. la Cl sus si jos pentru octet)
Na+[ Cl ]- (electr. la Cl sus si jos pentru octet)
Numarul de electroni cu care se modifica configuratia atomului reprezinta electrovalenta si corespunde numarului de sarcini elementare ale fiecarui ion. Ionii monoatomici au în general un numar mic de sarcini, determinat în principal de bilantul energetic endoterm la formarea lor.
Stabilitatea ionilor este cu atât mai mica cu cât disproportia dintre sarcina nucleara si deficitul sau excesul de electroni creste. Astfel se explica hidroliza carburilor, azoturilor si sulfurilor ionice ale unor mretale di- si tri- valente. Ex:
Al4C3+12H2O=4Al(OH)3+3CH4
Ca3N2+6H2O=3Ca(OH)2+2NH3
Ionii poliatomici sau complecsi cu un numar mai mare de sarcini sunt mai stabili decât cei monoatomici de aceeasi sarcina, deoarece aceasta se repartizeaza pe toti atomii prezenti: ex. PO43-; [Fe(CN)6]3-; [Fe(CN)6]4- s.a.
În afara de configuratia de octet, exista si alte configuratii suficient de stabile ale ionilor metalelor tranzitionale care dau structuri cu substratul (n-1) incomplet (ex. n-1)s2p6d6 la Fe2+s.a.), semiocupat (ex. (n-1)s2p6d5) sau ocupat cu electroni (ex. (n-1)s2p6d10.
Formarea combinatiilor ionice respecta regulile lui Fajans:
- un atom trece cu atât mai usor în stare ionica cu cât configuratia electronica atinsa este mai stabila, sarcina ionului este mai mica si raza atomica este mai mare pentru cation si mai mica pentru anion;
pentru ca o legatura chimica sa fie stabila, la formarea ei trebuie sa se elibereze energie (proces exoterm); cu cât aceasta energie este mai mare, cu atât combinatia este mai stabila.
Prin transfer de electroni de la un atom la altul, între ionii formati se exercita forte de atractie electrostatica care genereaza retele cristaline cu degajare de energie, numita energie de retea (kj.mol.-1)
![]() Na(g)+ + Cl(g)- Na+Cl(s)-
Na(g)+ + Cl(g)- Na+Cl(s)-
Energia de formare a unei retele ionice, pentru o pereche de ioni monoatomici este rezultanta între doua energii potentiale: o componenta atractiva si o alta repulsiva. Se exprima în kj.mol-1 si reflecta taria legaturii ionice.
Pentru o pereche de ioni monoatomici (un mol)M+X- (sau Na+Cl-) se admite ca atât în faza gazoasa cât si în retele cristaline, ionii M+(Na+) si X-(Cl-) de forma sferica, se apropie pâna la o distanta minima, de echilibru, r, egala cu suma razelor ionice (r++r-) când energia potentiala (Ep) a sistemului este minima (curba 1 fig.1).
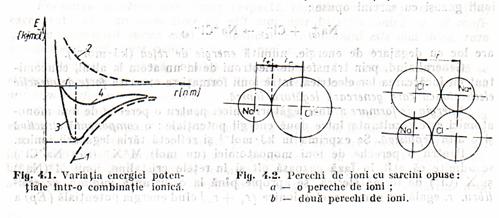
Ep se calculeaza
în baza legii lui Coulomb:
![]()
![]() (1)
(1)
unde: K=1/4pe
e - sarcina electrica elementara;
r = r++r- - distanta interatomica.
O apropiere în continuare a ionilor determina aparitia unor forte de respingere electrostatica ale învelisurilor electronice si nucleelor, care fac ca energia potentiala sa creasca (curba 2 fig.1). Componenta repulsiva a energiei potentiale se reprezinta prin termenul B/rn astfel ca relatia energiei potentiale totale devine:
![]() (2)
(2)
unde: n - exponent de repulsie care depinde de configuratiile electronice si compresibilitatea retelei;
B -
Variatia energiei potentiale totale a sistemului M+X- prezinta un minim (curba 3, fig.1)la distanta de echilibru între ioni ce corespunde stabilitatii maxime (în cazul NaCl, dist de echil. este de 0,276 nm).
Având în vedere forma lor sferica, fiecare ion poate atinge ioni de semn opus din orice directie. Totusi exista un numar maxim de ioni de semn contrar ce înconjoara la distanta minima un anumit ion într-o retea cristalina ionica. Acest numar limita se numeste numar (cifra) de coordinare (N.C.). Ca atare, la formarea retelelor cristaline pentru calculul energiei de formare trebuie sa se ia în considerare suma interactiilor de atractie si respingere a tuturor ionilor implicati, si ec. 2 devine:
![]() (3)
(3)
unde: A -
Ec.3 este valabila pentru o pereche de ioni monoatomici monovalenti si capata forma ec. 4 pentru retele ionice care contin ioni monoatomici polivalenti cu Zc si Za sarcini ale ionilor:
![]() (4)
(4)
Energia potentiala minima corespunde distantei de echilibru dintre ioni si se obtine prin diferentierea ec. 3 sau ec. 4 în raport cu distanta interionica, punând conditia ca la echilibru:
![]()
Ep minim reprezinta tocmai energia de legatura.
|