MODELUL GAZULUI IDEAL TEORIA CINETICO-MOLECULARA A GAZULUI IDEAL
Marimi legate de structura discreta a substantei
![]()
- ![]() numarul de moli
numarul de moli
- m masa totala de substanta
- N numarul total de molecule
- V volumul total ocupat d 525d36f e substanta
- ![]() masa molara (masa unui
mol de substanta),
masa molara (masa unui
mol de substanta), ![]()
- ![]() numarul lui Avogadro
(numarul de molecule dintr-un mol de substanta)
numarul lui Avogadro
(numarul de molecule dintr-un mol de substanta)
![]()
- ![]() volum molar (volumul
unui mol de substanta in conditii normale de temperatura si presiune)
volum molar (volumul
unui mol de substanta in conditii normale de temperatura si presiune)
![]()
Formula fundamentala a TCM
Presiunea unui gaz este numeric egala cu doua treimi din energia cinetica medie a tuturor moleculelor de gaz cuprins in unitatea de volum.
![]() , unde:
, unde:
n - numarul de molecule din unitatea de volum,
![]()
![]() - masa unei molecule
- masa unei molecule
![]() - media patratelor vitezelor moleculelor
- media patratelor vitezelor moleculelor
![]() - energia cinetica medie de translatie a unei molecule
- energia cinetica medie de translatie a unei molecule
Teorema echipartitiei pe grade de libertate
In cazul unui sistem aflat in echilibru
termodinamic la temperatura T, fiecare termen patratic independent care apare
in expresia energiei sistemului are o valoare medie egala cu ![]() .
.
![]() , unde k este constanta Boltzmann,
, unde k este constanta Boltzmann,
![]()
![]()
R - constanta universala a gazelor
![]()
i - numarul gradelor de libertate
i=3 gaz ideal monoatomic
i=5 gaz ideal biatomic
i=6 gaz ideal poliatomic
![]() energia cinetica medie
de translatie a moleculelor unui gaz ideal monoatomic
energia cinetica medie
de translatie a moleculelor unui gaz ideal monoatomic
Ecuatia termica de stare a gazului ideal
![]()
Ecuatia calorica de stare a gazului ideal
![]() , unde U este energia interna a gazului
, unde U este energia interna a gazului
![]() gaz ideal monoatomic
gaz ideal monoatomic
Viteza termica
![]()
Capitolul: Termodinamica si fizica moleculara
Tema: Legile experimentale ale gazelor
Notam:
t - temperatura empirica [t]=1oC (grad Celsius)
T - temperatura absoluta [T]=1K (Kelvin)
Legea Boyle - Mariotte sau legea transformarii izoterme (t=const., m=const.)
Presiunea unui gaz
aflat la temperatura
![]()

Legea Gay - Lussac sau legea transformarii izobare (p=const., m=const.)
Variatia relativa a volumului unui gaz mentinut la presiune constanta este direct proportionala cu temperatura.
![]()
Volumul unui gaz,
aflat la presiune

coeficent de dilatare izobara
Pentru o masa
![]()
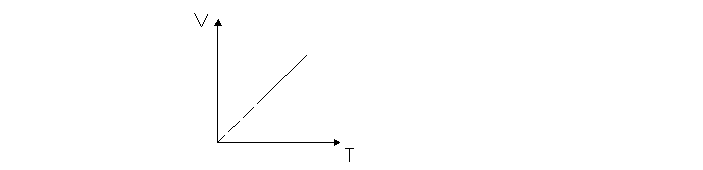
Legea Charles sau legea transformarii izocore (V=const., m=const.)
Variatia relativa a presiunii unui gaz mentinut la volum constant este direct proportionala cu temperatura.
![]()
Presiunea unui gaz mentinut la volum constant este direct proportionala cu temperatura.
![]()
Raportul dintre presiunea unui gaz mentinut la volum constant si temperatura absoluta a gazului ramane constant.
![]()
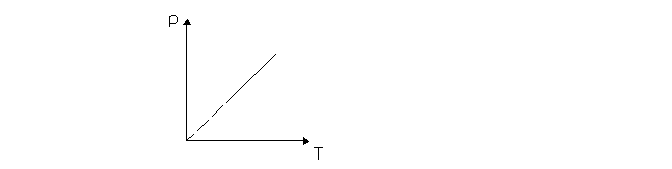
Ecuatia generala a gazelor. Ecuatia Clapeyron - Mendeleev
Pentru o masa constanta de gaz care sufera o transformare generala:

- ecuatia termica de stare (Clapeyron - Mendeleev)
|