REACTII IN FAZA LICHIDA
Solventii organici au jucat un rol important in dezvoltarea multor produsi chimici. Acestia sunt utilizati, de exemplu, in producerea compusilor farmaceutici cu puritate ridicata, in producerea vopselurilor volatile, in producerea cernelurilor cu uscare rapida si in aplicatiile aerosolurilor. In ultimele trei aplicatii, la nivel domestic, toti solventii sunt eliberati in atmosfera in timp ce aplicatiile industriale utilizeaza instalatii "end-of-pipe" pentru recuperarea a cat mai mult solvent fie pentru a fi reutilizat, fie pentru a fi depozitat in conditii sigure. In producerea chimicalelor, solventii sunt utilizati in cantitati mari intr-un numar mare de operatii unitare precum extractii, recristalizari sau dizolvarea solidelor pentru a fi manipulate mai usor. Unul dintre cele mai importante roluri jucate de solventi in industria chimica este cel de solvatare al reactantilor permitand omogenizarea amestecului reactant, marirea viteza reactiei printr-o amestecare adecvata dar si scaderea consumului energetic al reactiei. Multe dintre aceste aplicatii utilizeaza compusi organici volatili (VOCs) ca solventi datorita usurintei de separare sau volatilizare. VOC-urile au o presiune de vapori remarcabila la temperatura camerei; din acest motiv, la nivel industrial, existand multe pierderi din diverse surse. Alte pierderi importante au loc in timpul transportului iar acestea sunt responsabile de majoritatea emisiilor de compusi organici volatili.
Principalul efect al compusilor organici volatili asupra mediului este cel de distrugere al stratului de ozon si de formare a radicalilor liberi prin procese de oxidare cu aerul atmosferic. Pe de alta parte acestia prezinta o serie de efecte nocive asupra sanatatii umane, cele mai importante si frecvente fiind: iritatiile conjuctivale, dureri de cap, reactii de alergii si eruptii ale pielii, stare de oboseala, etc. Datorita acestor efecte nocive, in ultimii ani au aparut legislatii foarte stricte privind controlul emisiilor 636i89g de solventi si masuri de scadere al nivelului de emisie. Din pacate insa un astfel de control poate fi asigurat doar la nivel industrial, emisiile datorate utilizarii lor in domeniul domestic continuand sa se realizeze in atmosfera sau in ape.
Un studiu al emisiilor de compusi volatili din solventi arata ca aproape jumatate din emisiile existente provin din operatiile de acoperire ale suprafetelor, inclusiv din vopsirea masinilor in timp ce procesele non-industriale (domestice) sunt responsabile de 40% din emisiile de VOC. Acestea din urma includ utilizarea masiva a pesticidelor si vopsilurilor. Emisiile VOC din procesele de fabricare ale chimicalelor reprezinta o fractie relativ mica din emisiile globale, dar utilizarea acestor chimicale duce la o crestere remarcabila a procentelor de producere a deseurilor provenite din fabricile de chimicale. In plus, imflamabilitatea si pericolul expunerii muncitorilor la VOC duc la cresterea costurilor de capital prin aplicarea aparatelor de masura si control al acestor emisii. Datorita multitudinii de compusi organici volatili si a multitudinii de efecte ale acestora, la ora actuala exista multe solutii tehnice la aceasta problematica, fiecare dintre acestea avand un anumit potential de aplicare. Dar oricat de dezvoltate ar fi aceste solutii tehnice, pericolul exista.. Iata de ce la ora actuala se cauta alternative ale solventilor organici volatili, cateva dintre acestea fiind: solventii organici nevolatili, procesele care au loc fara solvent, fluidele supercritice, procesele care au loc in apa, lichidele ionice, solventi bifazici florurati.
Chiar daca eliminarea compusilor volatili din toate procesele de fabricare ale chimicalelor este principalul scop trebuie avut in vedere si faptul ca procesele alternative pot uneori decurge cu transfer energetic si transfer de masa scazut datorita vascozitatii limitate. Astfel de efecte pot duce la o crestere a consumului energetic sau o producere a unor compusi cu puritate scazuta, astfel de compusi necesitand cantitati mari de solventi in etapele ulterioare de purificare. Nu toti solventii organici volatili prezinta acelasi grad de periculozitate. Urmatorul tabel prezinta cei mai utilizati solventi in termenii punctului de fierbere, punctului de aprindere si a gradului de periculozitate:
Proprietatile solventilor organici volatili
|
Solvent |
Pct. de fierbere (0C) |
Pct. de aprindere (0C) |
Indicator de periculozitate |
|
izopropanol |
Nu |
||
|
acetat de etil |
Nu |
||
|
2-butanona |
Iritant |
||
|
1-butanol |
Daunator |
||
|
toluen |
Daunator |
||
|
tetrahidrofuran |
Iritant |
||
|
metanol |
Toxic |
||
|
diclormetan |
nu |
Daunator Posibil cancerigen |
|
|
hexan |
Daunator |
||
|
cloroform |
nu |
Posibil cancerigen |
Alegerea utilizarii unui solvent depinde de multi factori, nu in ultimul rand de usurinta lui de reciclare, usurinta de manuire a materialelor cu punct scazut de inflamabilitate, pret si, binenteles, performanta. Daca trebuie utilizat un solvent organic este de preferat unul dintre cei prezentati la inceputul tabelului de mai sus datorita periculozitatii scazute asupra mediului si sanatatii umane.
Exista o perceptie gresita cum ca cele mai multe chimicale sunt fabricate in solventi organici. De fapt cele mai multe chimicale comune, de uz larg, sunt fabricate in procese fara solvent, sau in procese in care cel putin unul dintre reactanti actioneaza si ca solvent. Exemple tipice de astfel de procese aplicate la scara larga sunt: fabricarea benzenului, al metanolului, al metil-tertbutil-eterului (MTBE), al fenolului si a polipropilenei. Pe langa acestea exista si procesele catalitice heterogene in faza gazoasa care au fost deja discutate.
Incepand cu anii 1980, MTBE a avut o contributie semnificativa in scaderea emisiilor VOC din gazele de esapament ale masinilor datorita proprietatilor acestuia de a arde "curat" producand doar o cantitate mica de hidrocarburi ca produsi secundari. MTBE este fabricat in reactoare cu pat fix, prin trecerea unui amestec de 2-metilpropena si metanol in exces peste o rasina acida schimbatoare de ioni:
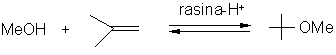
Reactia are loc in faza lichida, la temperaturi de 70-900C si presiuni pana la 8 atm. Functie de materia prima, randamentul poate atinge valori de 90%. 2-Metilpropena utilizata ca materie prima poate proveni din doua surse. Majoritatea provine din cracarea titeiului ca amestec de hidrocarburi C4. Acest amestec contine circa 30% 2-metilpropena, restul reprezentand hidrocarburi nereactive precum butena. Cea de-a doua sursa de 2-metilpropena provine din prodcerea oxidului de propilena prin epoxidarea propenei cu t-butilperoxid. In acest caz se utilizeaza 2-metilpropena pura in fabricarea MTBE, reactia necesitand presiuni mai scazute decat in primul caz.
In general, multe reactii care implica reactivi miscibili sau partial miscibili pot avea loc in absenta solventului, adesea in conditii blande. Uneori se utilizeaza solventi total nejustificat si fara rost doar pentru ca procesele sunt aplicate direct din studiile de laborator fara o dezvoltare adecvata ale acestora. Acesta este un exemplu foarte bun de necesitate de lucru in echipe multidisciplinare care pot fi hotaratoare in alegerea unor optiuni alternative. Provocarea adresata multor cercetatori este cea de dezvoltare a unor sinteze fara solvent pentru fabricarea de chimicale fine solide, mult mai complexe din punct de vedere structural si care necesita utilizarea de reactivi solizi cu puncte de topire ridicate. Daca astfel de procese pot fi aplicate si daca, mai mult, decurg cu randamente si selectivitati marite atunci ele indeplinesc cu succes conceptul TBL ("Triple Bottom Line" - mediu, economic, social - CURS 3-). Un exemplu in acest sens este sinteza Raston a piridinelor complexe. Sinteza implica reactii de aditie aldolica si aditie Michael fara solvent, ambele decurgand cu randamente ridicate. Reactia aldolica este realizata prin macinarea hidroxidului de sodiu cu benzaldehida si acetil-piridina (ambele lichide). Produsul de reactie este un solid care se formeaza dupa doar cateva minute. O macinare ulterioara a acestuia cu aceeasi acetil-piridina sau cu una diferita duce la reactia de aditie Michael. Ambele reactii au loc cantitativ, spre deosebire de reactia care se realizeaza in solvent (etanol) si care decurge cu un randament de doar 50%. Unul dintre avantajele acestei metodologii de lucru este acela ca nu este necesara purificarea prin recristalizare in solventi organici a produsului de reactie inainte de aplicarea etapei finale de sinteza, care implica tratamentul cu acetat de amoniu in acid acetic. Exista si cazuri in care astfel de produsi nu se formeaza daca se utilizeaza solvent.
Astfel de tehnici au devenit destul de uzuale la nivel de laborator. De exemplu, reactiile Friedel-Crafts - sunt recunoscute ca unele dintre cele mai daunatoare reactii asupra mediului, datorita utilizarii de catalizatori acizi Lewis ne-recuperabil si a solventilor clorururati. Tehnica de laborator de macinare s-a utilizat cu succes si in acest caz: reactia dintre benzen si 2-bromopropan in prezenta de catalizator solid clorura de aluminiu cu formarea produsului trialchilat. Reactia evita utilizarea solventilor clorurati, dar tot sunt necesari solventi organici pentru separarea produsului de reactie dupa "stingerea" in apa. Cateva dintre aceste reactii prin "macinare" se aplica chiar la scala comerciala. Unul dintre reactoarele frecvent utilizate in astfel de reactii sunt morile cu bile frecvent utilizate si in macinarea minereurilor.
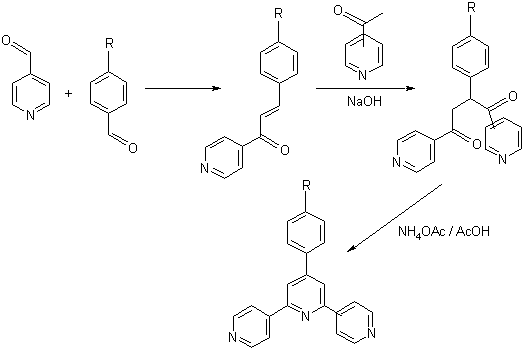
Potentialul sintezelor fara solvent este relativ larg, cu exemple de multe reactii foarte cunoscute precum transesterificarea, condensarea sau reactia de rearanjare. Multe dintre ele nu utilizeaza surse termice conventionale pentru asigurarea necesarului energetic al reactiei deoarece transferul de caldura este de obicei destul de slab. Cele mai indicate surse energetice in acest cazuri sunt microundele sau sursele fotochimice care duc la o inbunatatire remarcabila atat a randamentului de reactie cat si a selectivitatii in produsul dorit. Cele mai multe aplicatii comerciale ale sintezelor fara solvent s-au dezvoltat in domeniul chimicalelor fine si a farmaceuticelor; utilizarea solventilor este insa imposibil de evitat in multe cazuri, in aceste cazuri fiind necesara gasirea unor solventi alternativi mult mai putin daunatori mediului si sanatatii umane.
Un fluid supercritic (SCF) este definit ca un compus situat, in diagrama de faza, deasupra presiunii (Pc) si a temperaturii sale critice (Tc). Deasupra acestor puncte materialul exista intr-o singura stare de condensare dar cu proprietati intre cele ale unui gaz si a unui lichid. Simplist, procesul poate fi vizualizat ca o cumulare a densitatii unui lichid cu cea a starii gazoase pe linia de coexistenta a celor doua faze, conform diagramei de faze:
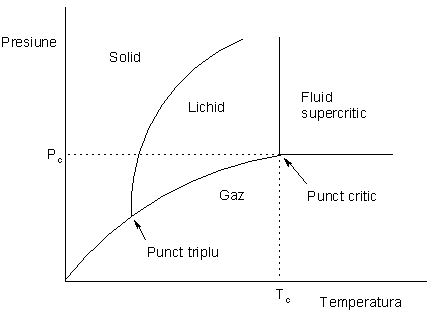
Deoarece cresterea temperaturii unui lichid determina scaderea densitatii acestuia iar cresterea presiunii unui gaz determina cresterea densitatii acestuia, la punctul critic aceste densitati devin echivalente. In general, un lichid supercritic poseda densitati apropiate de cele ale unui lichid si vascozitati similare gazelor, aceste proprietati determinand cresterea vitezei de difuzie. Proprietatile fluidelor supercriice pot fi ajustate prin modificarea temperaturii si a presiunii, atata timp cat acestea raman deasupra punctului critic. In principiu, prin cresterea presiunii la temperatura critica, se pot forma solide, dar pentru cele mai multe materiale presiunea necesara pentru asta este extrem de ridicata (de exemplu, pentru CO2 - 5.700 bar). Temperatura si presiunea critica variaza foarte mult de la material la material:
Punctele critice pentru unele dintre cele mai comune fluide supercritice
|
Material |
Tc (0C) |
Pc (bar) |
Amoniac | ||
|
Dioxid de carbon | ||
|
Etan | ||
|
Etena | ||
|
Floroform |
| |
|
Propan | ||
|
Apa |
Multe dintre aplicatiile in fluide supercritice sunt limitate de utilitatea practica a acestor materiale; de exemplu - apa - a caror puncte critice de temperatura si presiune sunt foarte ridicate.
Fluidele supercritice sunt cunoscute de sute de ani dar potentialul lor urias este recunoscut doar din 1980. De aceea, doar un numar relativ mic de procese care necesita temperaturi si presiuni ridicate au fost realizate in regim supercritic. Doua dintre cele mai cunoscute astfel de procese sunt: i) polimerizarea radicalica a etenei la presiune si temperatura ridicata cu producerea polietenei de densitate joasa; ii) procedeul Haber de producere a amoniacului, care opereaza deasupra punctului critic al amoniacului.
Pana la mijlocul anilor 1980 acestea erau doua dintre cele cateva procese realizate in conditii supercritice. Avantajele aduse de acesta tehnica de lucru in conditii supercritice sunt: i) imbunatatirea transferului de masa si caldura datorita vitezei ridicate de difuzie si a vascozitatii scazute; ii) posibilitatea ajustarii proprietatilor solventului prin varierea temperaturii si a presiunii; iii) posibilitatea de operare pe un domeniu larg in domeniul supercritic; iv) indepartarea usoara a solventului si reciclarea lui.
Asa cum s-a specificat, materiale diferite poseda puncte critice extrem de diferite, mai mult sau mai putin accesibile. Aceasta duce la intrebarea: este valoarea fluidelor supercritice reala in Chimia verde? La aceasta intrebare se poate, in mod simplist, raspunde "daca un efect precum cresterea vitezei de reactie sau cresterea solubilitatii este favorizat prin utilizarea unui solvent in stare supercritica, atunci fluidul supercritic poate fi considerat ca un element "verde"". Exista insa cazuri in care, pentru a opera in conditii supercritice, este necesar un aport energetic mult prea mare pentru ca procesul sa fie considerat "verde". Iata de ce notiunea de element "verde" a fluidelor supercritice trebuie privita prin prisma inlocuirii solventilor organici toxici cu aceste fluide mult mai benigne, cum ar fi apa sau dioxidul de carbon. In acest caz se poate vorbi de o imbunatatire remarcabila a procesului atat din punct de vedere al protectiei mediului cat si cel al avantajelor aduse de tehnica in sine.
Dioxidul de carbon supercritic (scCO2)
Cele mai importante aplicatii ale scCO2 sunt cele de solvent de extractie si solvent de reactie. O alta aplicatie foarte importanta pentru mediu, chiar daca este aplicata la scara mica, este cea de utilizare ca solvent/ mediu de dispersare pentru acoperiri de suprefete prin spreiere. Avantajele si dezavantajele utilizarii scCO2 ca solvent in astfel de aplicatii sunt redate in tabelul de mai jos:
Avantajele si dezavantajele utilizarii scCO2 ca solvent
|
Avantaje |
Dezavantaje |
|
Netoxic |
Utilizarea echipamentelor de presiune ridicata |
|
Indepartare usoara |
Echipamente relativ scumpe |
|
Potential de reciclare |
Solvent relativ slab |
|
Neinflamabil |
Reactiv cu nucleofilii puternici |
|
Solubilitate ridicata a gazelor |
Posibile probleme de transfer de caldura |
|
Solvatare slaba | |
|
Viteze de difuzie mari | |
|
Usurinta de control a proprietatilor | |
|
Transfer bun de masa | |
|
Disponibil |
In termenii reactiei chimice, unul dintre cele mai mari avantaje este legat de miscibilitatea scCO2 cu gazele, avantaj datorat naturii asemanatoare a fluidului cu cea a gazelor. Aceasta poate conduce la cresteri substantiale ale vitezei de reactie pentru procese precum hidrogenarea, fata de cele in care se utilizeaza solventi organici conventionali care sunt solventi relativ slabi pentru hidrogenul molecular. In cazul reactiilor exoterme insa pot apare probleme datorita transferului slab de caldura caracteristic pentru aceste sisteme. CO2 prezinta proprietati interesante si, de multe ori, neuzuale pentru un solvent. Fiind nepolar, ar fi de asteptat ca acesta sa fie un solvent bun pentru hidrocarburi, dar nu este asa datorita momentului sau de cuadrupol ridicat. Pentru a inlatura acest neajuns s-au incercat diverse solutii intre care si utilizarea unui co-solvent. Momentul ridicat de cuadrupol il face insa un solvent foarte bun pentru molecule polare mici precum metanolul si cofeina. Absenta polaritatii are o influenta pozitiva asupra vitezei de reactie deoarece dioxidul de carbon nu se coordineaza puternic la multi catalizatori sau complecsi solvatati. Deoarece CO2 este relativ inert acesta nu reactioneaza cu nucleofilii puternici precum aminele, ceea ce face ca acesta sa nu poata fi utilizat ca solvent in anumite reactii.
Procese de extractie in scCO2
Unul dintre cele mai raspandite procese de extractie realizate in scCO2 este extractia cofeinei din cafea. Inainte de 1980 in acest proces era aplicat ca solvent de extractie diclormetanul. Un astfel de solvent clorurat putea avea insa potentiale efecte adverse asupra sanatatii si chiar daca nu au existat dovezi directe ale efectelor nocive asupra sanatatii datorita reziduurilor clorurate din cafeaua decofeneizata, exista intotdeauna un risc. Procedeul cu scCO2 ofera avantaje economice, asupra mediului si a sanatatii umane.
Principiul de extractie a cofeinei din boabele de cafea, in scCO2 este redat in figura de mai jos:
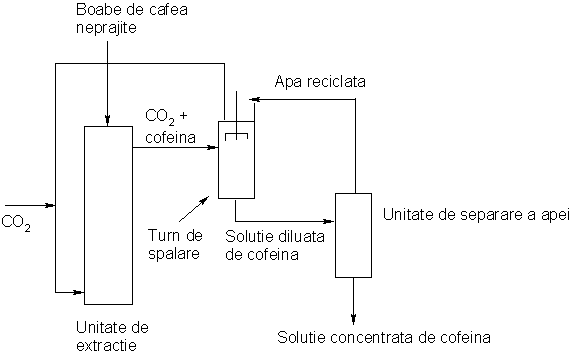
Boabele de cafea (umede si neprajite) si CO2 sunt introduse in contracurent in unitatea de extractie adusa in conditii supercritice. Cofeina este selectiv extrasa in CO2 iar solutia obtinuta este trimisa in turnul de spalare unde se extrage cofeina prin micsorarea presiunii. Dioxidul de carbon este recirculat in unitatea de extractie. Extractia cofeinei in apa este necesara pentru a evita scaderea prea mare a presiunii CO2, recomprimarea acestuia necesitand apoi un nou consum energetic. Urmatoarea etapa este cea de separare a cofeinei (utilizata pentru fabricarea diverselor bauturi racoritoare dar si a unor compusi farmaceutici) din apa. Distilarea este un proces puternic energofag din acest motiv multe fabrici moderne utilizand tehnologii precum osmoza inversa sau membrane pentru concentrarea solutiilor apoase de cofeina. Alte doua observatii interesante legate de acest proces sunt: i) procesul utilizeaza boabe de cafea neprajite pentru a evita extractia, pe langa cofeina, si a unor uleiuri aromate produse prin prajirea acesteia; ii) procesul necesita existenta unui anumit grad de umiditate a boabelor de cafea pentru a elibera cofeina din complecsii existenti in boabe; umiditatea boabelor era necesara si in procedeul cu diclormetan.
Datorita naturii benigne si a eficientei acest tip de extractie a devenit din ce in ce mai interesant pentru industriile alimentare si cea de arome si parfumuri. Un exemplu este cel de extractie a grasimilor din cipsurile de cartofi: cipsurile de cartofi au un continut caloric foarte ridicat (45% grasimi) iar prin extractie cu scCO2 acest continut poate fi redus la jumatate fara a pierde din arome. Solubilitatea relativ ridicata a trigliceridelor de acizi grasi este importanta si pentru studiile privind separarea uleiurilor vegetale din soia.
Un alt succes comercial al aplicarii tehnologiei cu scCO2, si care poate fi considerat un proces de extractie, este curatarea uscata. Traditional, cele mai multe procese de curatare uscata utilizau solventi clorurati, ititial tetraclorura de carbon iar mai apoi percloroetena ("perc"). Chiar daca recuperarea si reciclarea solventului este eficienta, aceste procedee prezinta diverse dezavantaje, incluzand contaminarea solului care, mai mult, poate contamina panza freatica de apa si faptul ca "perc" este suspect cancerigen. Aplicarea procedeului cu scCO2 prezinta unele avantaje tehnice asupra celui cu "perc": materiale care nu pot fi curatate cu "perc", precum pielea, blanurile si unele sintetice, sunt curatate fara probleme cu scCO2. Un alt avantaj se refera la improspatarea culorilor din unele tesaturi. Curatarea uscata repetata aplicata cu "perc" duce la pierderea intensitatii culorilor ceea ce nu se intampla cand se utilizeaza scCO2.
Realitatea este ca cele mai multe procese de curatare cu CO2 de inalta presiune opereaza la temperaturi si presiuni sub punctul critic (adica cu CO2 lichid) din motive economice. Dar deoarece lichidul este apropiat de punctul critic, multe dintre proprietatile lui, printre care si densitatea si vascozitatea sunt similare celor ale scCO2. Aceste doua proprietati sunt, in primul rand, responsabile pentru eficienta procesului, atata timp cat CO2 este capabil sa penetreze in structura fibroasa a tesaturii care urmeaza a fi curatata. Datorita proprietatilor de solvent al scCO2, acesta este eficient pentru indepartarea petelor de grasime si murdarie dar nu este atat de eficient pentru indepartarea petelor provenite din vinul rosu, galbenusul de ou, etc. De aceea, sistemele comerciale utilizeaza si surfactanti. Acesti surfactanti difera insa de cei utilizati in procesele de curatare umeda deoarece ei trebuie sa fie compatibili cu pata si CO2. Astfel de surfactanti sunt patentati si nu se cunoaste structura lor exacta dar se crede ca contin grupari florurate pentru ai face compatibili cu CO2.
Reactii chimice in scCO2
Utilizarea scCO2 ca solvent de reactie reprezinta un domeniu de mare actualitate in cercetare. Lipsa de atentie anterioara se datoreaza, in parte, dificultatii de realizare a experimentelor la presiune atat de inalta in laboratoarele universitare. Unul dintre cele mai studiate domenii este polimerizarea; in acest caz fluidele supercritice ofera posibilitatea obtinerii de polimeri cu mase moleculare diferite prin modificarea densitatii mediului printr-o simpla modificare a presiunii. Polimerizarea monomerilor cu continut de flor si siliciu a fost una dintre reactiile cele mai studiate datorita lipsei de solubilitate a acestor materiale in solventii organici.
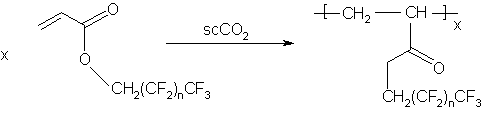
Polimerizarea
radicalica a monomerilor acrilici (utilizand un initiator de radicali liberi)
cu grupari florurate decurge la temperaturi de 600C si presiuni de
peste 200 bar. Este interesant faptul ca initiatorul se descompune mult mai lent
in scCO2 decat in
solventii conventionali. Aceasta se datoreaza absentei efectului de "cusca" in
mediu cu vascozitate scazuta.
Unul din scopurile polimerizarii materialelor polare precum acrilatii, in scCO2 este cel de a construi structuri cu greutate moleculara pana la una atractiva din punct de vedere comercial, inainte de a fi extrase din solutie. Prin utilizarea unor cantitati mici de agenti de dispersare, precum surfactantii, cu grupari compatibile cu CO2 (de ex. siloxanii), polimerul poate fi pastrat in solutie pana se obtine masa moleculara dorita. Dioxidul de carbon supercritic reprezinta, de asemenea, un solvent inert atractiv deoarece, teoretic, acesta nu favorizeaza nici un transfer de sarcina, chiar din radicali cu electrofilicitate ridicata. Acest efect a putut fi utilizat in polimerizarea tetrafloroetenei. Compania Dupont a comercializat recent un proces pentru producerea politetrafloroetenei (PTFE) in scCO2, acesta inlocuid utilizarea solventilor cloroflorocarbonici care distrug stratul de ozon.
De altfel, pana la ora actuala s-au dezvoltat mai multe procese de polimerizare a monomerilor neflorurati. Prin analiza interactiilor polimer- scCO2, atat entropic cat si entalpic, a fost posibila prepararea unor polimeri cu un anumit "design", care pot duce la prepararea unor sisteme mult mai utile comercial. Un exemplu este dat de sinteza polieter-policarbonatilor din propilen oxid, utilizand dioxidul de carbon atat ca solvent cat si ca reactant, in prezenta unui catalizator solid de Zn sau Al:
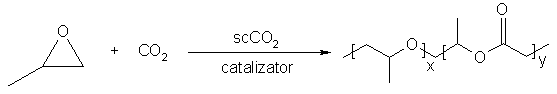
Acest polimer este foarte flexibil datorita prezentei gruparii carbonat si prezinta doar interactii slabe inter-lanturi polimer-polimer. Ambele proprietati favorizeaza solibilizarea acestuia in solvent.
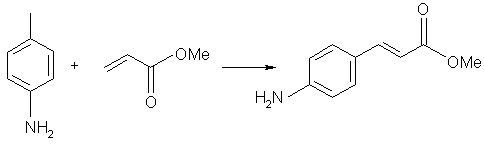
Reactiile de formare a legaturii carbon-carbon
catalizate de Pd, precum reactiile Heck si Suzuki, sunt metode extrem de
eficiente pentru sinteza intermediarilor de sinteza fina si farmaceutica, dar
ambele reactii se confrunta cu probleme legate de separarea catalizatorului.
Dioxidul de carbon supercritic ofera o potentiala solutie pentru aceasta
problema deoarece, in principiu, produsul poate fi separat din amestecul de
reactie in timp ce catalizatorul activ ramane in solutie. Principalul
dezavantaj al acestei metode este acela ca liganzii fosfinici florurati sunt
extrem de scumpi si dificil de preparat. Studii recente au aratat ca rezultate
similare pot fi obtinute daca se utilizeaza fosfine mult mai conventionale cu
sursa Pd florurat [de ex., Pd(OCOCF3)2]. Cateva reactii
de formare de legaturi C-C realizate in scCO2,
catalizate de complecsi de Pd sunt date in schema urmatoare:
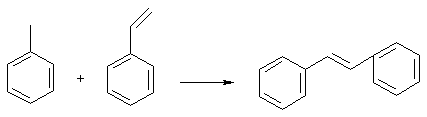
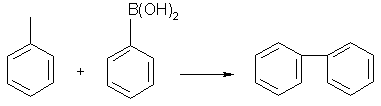
Primul exemplu de reactie este foarte interesant deoarece CO2 ofera protectia gruparii aminice prin formarea acidului carbamic; acesta evita necesitatea unei etape de reactie aditionale care sa utilizeze reactivi traditionali.
|