SINTEZA SI STEREOCHIMIA UNOR SISTEME BICICLO[n.n.0]OXAZANICE FUNCTIONALIZATE CU SISTEME p-DEFICITARE
Prezentul RAPORT prezinta rezultatele obtinute de-a lungul celor trei ani de cercetare in do-meniul compusilor biciclo[3.3.0]oxazanici functionalizati cu sisteme (pi)deficitare - derivati diazinici, precum si a sistemelor dimerice (pi)deficitare.
A. SINTEZA DE DER 24124i810y IVATI (DI)AZINICI
Importanta sistemului azadioxabiciclooctanic deriva, in special, din asemanarea, formala, cu unitatea structurala de baza a alcaloizilor de tip pirolizidinic.

Schema 1
Conform datelor de literatura, se cunosc o multitudine de derivati 1-aza-3,7-dioxabiciclo [3.3.0]octanici C-substituiti cu actiune pesticida, biocida, plastifianta.1-8 Luand in considerare actiunea farmacologica a acestora, precum si accesibilitatea lor, s-a incercat introducerea acestor sisteme pe scheletul unor compusi (pi)deficitari prin deplasarea nucleofila a unor grupe fugace.
In acest scop, s-a utilizat 5-hidroximetil-1-aza-3,7-dioxabiciclo[3.3.0]octanul a carui grupare C-5 hidroximetilica permite functionalizarea in continuare. Ca si intreaga serie, se obtine usor din 2-amino-2-hidroximetilpropan-1,3-diol (binecunoscut in domeniul analitic sub denumirea de TRIS) si formaldehida, la reflux, in solvent aromatic si cu indepartarea azeotropa a apei rezultata din reactie (1a, Schema 2).9

Schema 2
Compusul 1a, abreviat mai de parte ca 5-(HO-CH2)-ADBO (AzaDioxaBicicloOctan) este susceptibil sa dea reactii triviale de O-acilare la functiunea hidroximetilica si de cuaterniazare la atomul de azot N-1, cap de punte.10
Atomul (atomii) de clor a - grefati fata de un aza-atom dintr-un heterociclu (pi)deficitar de tip (di)azinic ne-a(u) aparut ca si cloruri de imidoil mascate si deci susceptibile unui atac nucleofil din partea bicicloderivatului 1a, eventual cu nucleofilicitate accentuata prin transformare in forma anionica (O-metalare, Schema 3). Reactia este, evident, analoaga clasicelor substitutii nucleofile ale a-halogenului labilizat de un schelet heteroaromatic (pi)deficitar.11

Schema 3
Preliminar, s-a investigat O-metalarea lui 1a. Numai derivatul O-potasat al acestuia s-a dovedit util efectuarii in continuare a sintezelor. Reactia a fost apoi testata asupra 2-cloropiridinei, obtinandu-se derivatul 3 (X = C, Schema 3) cu un randament in substanta izolata de 60%. 2-Bromopiridina, in schimb, s-a aratat inerta fata de reactivul nostru (pledand astfel pentru un mecanism SN2Ar via complex Jackson-Meisenheimer) in vreme ce, in cazul 4-cloropiridinei, a fost observata doar descompunerea amestecului de reactie.
Performante mult mai promitatoare au fost obtinute in seria diazinica.
Rezultatele cantitative si calitative sunt redate in continuare (Schemele 4 - 6).

Schema 4

Schema 5

Schema 6
Fezabilitatea sintezelor a fost investigata in seriile pirazinica (Schema 4), pirimidinica (Schema 5) si piridazinica (Schema 6). Ca si strategie generala, s-a urmarit, in fiecare caz, intr-o prima etapa, substitutia exhaustiva a atomilor de clor, urmata apoi de evidentierea aspectele de regio- si chemio- selectivitate. Toate randamentele redate in Schemele 4 - 6 se refera la substanta izolata si caracterizata complet (RMN, IR, Spectru de Masa, etc). Nici unul dintre randamente nu este optimizat. Compozitiile care reflecta selectivitatile observate sunt calculate pe baza spectrelor 1H-RMN efectuate asupra amestecurilor brute de reactie, prin integrarea semnalelor din zona aromatica, excelent separate.
Ca si metodologie generala de sinteza s-a remarcat simplitatea deosebita a acesteia. Astfel, s-a preparat mai intai derivatul O-potasat al lui 1a, prin actiunea hidrurii de potasiu asupra lui 1a, in tetrahidrofuran anhidru, timp de o ora, la slaba incalzire. Condensarea cu cloroderivatii a avut loc, de regula, la temperatura ambianta. Toate sintezele au fost urmarite prin cromatografie in strat subtire, metoda care s-a dovedit pe deplin eficace scopului propus. Neasteptat de simpla s-a dovedit izolarea compusilor.
Astfel, la stoparea reactiei cu apa si extractie a materialului organic intr-un solvent usor volatil si nemiscibil cu apa, materiile prime (eventual nereactionate) au ramas, practic, in faza apoasa. Prelu-crarea extractului organic a furnizat produsul urmarit prin simpla recristalizare.
In general, compusii exhaustiv substituiti s-au izolat in maniera descrisa anterior. Fluctuatiile de randament consemnate de la o serie la alta se datoreaza, in principal, stabilitatii reduse a nucleofilului fata de substratul policlorurat, de reactivitate variabila (in scadere pirimidine > pirazine > piridazine).
Problemele de selectivitate au fost rezolvate in maniera unitara in toate seriile, prin aceea ca reactantii (forma potasata a lui 1a si policlorodiazina) au fost pusi in contact la -78oC, pentru a inhiba astfel declansarea procesului. Amestecul a fost lasat apoi, treptat sa ajunga la temperatura ambianta. Selectivitatile obtinute sunt comparabile cu cele ale ionului metoxi, in conditii similare, si in concordanta cu reactivitatile piridazine > pirazine > pirimidine.
Semnalam si doua cazuri surprinzatoare dar deosebit de relevante.
a) in cazul disubstituirii selective a atomilor de clor de pe scheletul 2,4,6-tricloropirimidinei (Schema 5) dupa inlocuirea, in prima etapa a atomului de clor de la C-4 (normal asteptata), cel de-al doilea atom de clor inlocuit a fost cel de la C-2 si nu cel de la C-6, rezultand derivatul 2,4-disubstituit nesimetric (in locul celui simetric, 4,6-disubstituit). Comportarea este analoaga ionului fenoxid, apreciat drept un nucleofil moale.
b) in cazul prepararii derivatului metoxi-3,6-disubstituit al piridazinei (Schema 6) pornind din 3-cloro-6-metoxipiridazina, principala impuritate identificata ca produs secundar (si care explica randamentul, oarecum mai modest) a fost, in mod neasteptat, derivatul simetric-3,6-disubstituit cu resturi 5-(-O-CH2-)ADBO, identic cu cel izolat si caracterizat din reactia de substitutite exhaustiva a 3,6-dicloropiridazinei. Am fost astfel nevoiti sa acceptam deplasarea, de catre nucleofilul nostru, a anionului metoxi, mai putin nucleofil (si, eventual, mai puternic bazic).
Insusirile chelatizante, remarcabile ale noii clase de compusi sintetizati, au fost puse in evidenta prin analiza structurala a derivatului pirazinic 2,6-disubstituit cu resturi 5-(-O-CH2-ADBO). Diagrama ORTEP a acestuia este redata in Figura 1.
Structura, relevata prin difractometrie de raze X, este in perfect acord cu anticiparile teoretice. Astfel, in stare solida cristalina, au fost puse in evidenta doua conformatii inghetate, in relatie de diastereomerie una fata de cealalta, dupa cum urmeaza:
a) o forma chirala, cu pondere de cca. 87%, a carei diagrama este reprezentata in Figura 1 (unul dintre enantiomeri); asimetria de ansamblu provine din chiralitatea de acelasi sens a celor doua bicicluri (R,R in cazul de fata, vezi shema simplificata si incadrata)



Figura 1
b) o mezoforma, cu o pondere de cca. 13%, in care cele doua bicicluri au sensul chiralitatii opus (R,S)
Comportarea termodinamica a celor doua specii cristaline pare sa fie dictata de incluziunea, in canalele retelei cristaline, a moleculelor de diclorometan (solventul utilizat pentru depunere de cristale); intr-adevar, numai enantioforma poate include molecula de diclorometan fara a o distorsiona semnificativ, din punct de vedere configurational, dupa cum se arata mai jos:
a) in enantioforma, unghiurile Cl-C-H sunt semnificativ diferite: 115 respectiv 103o
b) in mezoforma, unghiurile Cl-C-H sunt de-asemenea diferite: 109 respectiv 101o si, precum se vede, diferite, la randul lor fata de enantioforma
De altfel, cele doua retele nu au fost apte masuratorii decat la cca. -20oC, temperatura la care diclorometanul s-a gasit inca inclus in retea; o data cu disparitia acestuia prin volatilizare, cristalele au devenit opace, inaccesibile determinarilor structurale. Stoichiometria gasita a fost cca. echimolara (1:0.96) intre compsul sintetizat si diclorometan.
B. FUNCTIONALIZAREA DERIVATILOR (DI)AZINICI PRIN METALARE
Functionalizarea heterociclilor azotati (pi)deficitari (piridina, diazine, benzodiazine) prin metalare a fost initiata si dezvoltata de catre grupul de la I.R.C.O.F (Institut de Recherche en Chimie Organique Fine), Rouen Reactia de metalare reprezinta o modalitate eficace de functionalizare regioselectiva a sistemelor (pi)deficitare, deoarece, spre deosebire de benzen si sitemele heterociclice (pi)excedentare, diazinele sunt dificil de functionalizat prin substitutie electrofila. De asemenea, in seria (pi)deficitara reactia de metalare este concurata de aditia nucleofila.
Metodologia functionalizarii prin orto-metalare este prezentata in Schema 7. Aceata consta in deprotonarea, in orto fata de o grupare directoare (denumita simbolic GOD), cu o baza tare. In continuare, intermediarul litiat poate reactiona cu diversi electrofili. Pentru evitarea reactiei de aditie nucleofila se lucreaza cu agenti de metalare putin nucleofili: LDA (di-iso-propilamidura de litiu) si LTMP (2,2,6,6-tetrametilpiperidilamidura de litiu).

Schema 7
Metalarea sistemelor 5-hetariloximetil-1-aza-3,7-dioxabiciclo[3.3.0]octanice, prezentate ante-rior, este sistematizata in Schema 8. Trebuie precizat ca s-au utilizat electrofili prochirali, in ideea evidentierii insusirilor heterofaciale ale grupei orto-directoare.
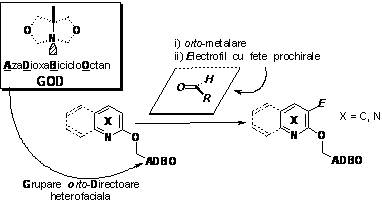
Schema 8
Rezultatele calitative si cantitative obtinute in cazul celor trei serii diazinice sunt prezentate in Schemele 9- 12.

|
Compus |
E |
Temp. (oC) |
Timp (h) |
Rand.a |
|
7a |
D |
98b |
||
|
7b |
Ph-CH-OH |
-78 la t.a. |
noapte |
51 |
|
7c |
Me-CH-OH |
41 |
||
|
7d |
Et |
80c |
||
|
7e |
I |
68 |
||
|
7f |
Sn(n-Bu)3 |
90d |
||
|
7g |
S-Ph |
73d |
aCompusi izolati prin flash cromatografie urmata de recristalizare (7b-e si 7g); pentru 7a monitorizare 1H RMN a crudului de reactie
b8 eq. DCl ca solutie 20% g/g D2O
cMeI ca electrofil; in amestecul de reactie s-a detectat mai putin de 10% metil derivat( monitorizare 1H RMN)
dClSn(n-Bu)3 (pentru 7f) si Ph-S-S-Ph (pentru 7g) ca electrofili
Schema 9

Schema 10

Schema 11

Schema 12
C. SISTEME DIMERICE (PI)DEFICITARE FUNCTIONALIZATE PRIN METALARE
Diversitatea grupelor orto-directoare, asociata cu marea reactivitate a intermediarilor litiati si a electrofililor ofera accesul la o mare varietate de noi combinatii polifunctionalizate. Astfel, grupe directoare ca halogeni, functiuni ce contin oxigen (OH, OR, OCONR2, OSONR2), azot (NHCOR, NHCOOR), sulf (SO2NR2, SOnR, n=1,2), carbon (COOH, CONHR, CONR2, COR, >C=N-OH) si-au dovedit eficacitatea, de-a lungul timpului, in sintezele organice.12,13
Ideea utilizarii gruparii 2-piridil ca si grupa directoare in reactiile de metalare apartine lui Zoltewicz si a fost aplicata in seria 2,2'-bipiridinelor.14
In scopul studierii reactiilor de metalare si functionalizare a diazinelor ne-am propus sa analizam rolul gruparii 2-piridil ca si grupa orto-directoare. Astfel, au fost sintetizati compusii 11-13, utilizand conditiile de cuplaj Stille (Schema 13).15

Schema 13
Metalarea compusilor 11-13 s-a realizat cu LTMP (2,2,6,6-tetrametilpiperidilamidura de litiu) la -78OC si in THF anhidru (Schema 14).

Schema 14
In continuare, intermediarii litiati au fost tratati la -78OC cu un exces (6 eq) de DCl/ D2O sau EtOD, in scopul obtinerii derivatilor 11-13-d. Conditiile de lucru si rezultatele analizei 1H RMN a brutului de reactie sunt prezentate in Tabelul 1.
Tabelul 1. Deuterarea prin litiere a 2-piridildiazinelor

|
Nr. |
Conditii de litiere |
Incorporare de deuteriu (%) δ (ppm) (multiplicitate) |
||||||||
|
In diazine |
In piridina |
|||||||||
|
n (eq.LTMP) |
t1 (min.) |
D+ |
t2 (h) |
| ||||||
|
-d |
DCl |
-a |
(s)b |
(m) |
(d) |
|||||
|
i) DCl ii) D2O |
i) - ii) 12 |
(d) |
(m) |
(d) |
||||||
|
i) DCl ii) H2O |
i) - ii) 48 |
(d) |
(m) |
(d) |
||||||
|
-d |
DCl/EtOD |
(s) |
(s) |
(s) |
(d) |
|||||
|
-d |
EtOD |
(d) |
(d) |
|||||||
|
EtOD |
(d) |
(d) |
||||||||
aWork up following immediately the quenching. b(s)-singlet, (d)-doublet, (m)- multiplet
Pe baza datelor prezentate in Tabelul 1, pot fi luate in considerare urmatoarele considerente:
1. Regioselectivitatea pe inelul diazinic: gruparea 2-piridil ca grupa orto-directoare
Spectrul 1H RMN al compusului 11-d arata o diminuare a intensitatii protonului mai dezecranat cu ca. 19% (H-3): singlet tipic la 9.61 ppm, originar din dubletul corespunzator al compusului 11, (4J3-5=1.5 Hz). In cazul compusului 12-d se observa o diminuare de ca. 89% a intensitatii singletilor aferenti protonilor H-2 si H-4(6). Cazul compusului 13-d este prezentat, ca exemplu (Figurile 2 si 3).

H-3' H-6' H-4 H-Ph H-5 H-4' H-Ph H-5'

Figura 2: Spectrul 1H RMN al compusului 13 (300 MHz, CDCl3, 25 oC)
Folosirea a 3 echivalenti LTMP/ EtOD conduce la disparitia, aproape in totalitate, a dubletului corespunzator protonului H-4, in timp ce dubletul corespunzator protonului H-5, din compusul 13, devine singlet in derivatul deuterat 13-d (Figura 3). Astfel, putem vorbii de o regioselectivitate absoluta de 93% la C-4 si de o regioselectivitate relativa de 100% in piridazina.
2. Regioselectivitatea pe inelul piridinic: diazinele ca grupe orto-directoare
Desi partiala, deuterarea in inelul piridinic este in intregime regioselectiva la C-3' si este influentata de excesul agentului de metalare (Tabelul 1). Intr-adevar, diazinele par sa se comporte ca
si grupe orto-directoare daca sunt grefate in a fata de piridina, dar puterea lor de orientare este mica.
![]()

Figure 3: Spectrul1H RMN al compusului 13-d (300 MHz, CDCl3, 25 oC)
Atribuirile RMN se bazeaza, de asemenea, si pe experimentele 1H-1H-2D-COSY. S-a gasit, astfel, ca semnalul corespunzator protonului H-6' (a fata de azotul piridinic) ramane neafectat, ca dd cu constantele de cuplaj 3J6'-5' 4.9 Hz, 4J6'-4' 1.8 Hz.12 Protonii H-4', -5' manifesta tiparul normal (ddd partial suprapus). Din contra, dubletul atribuit la H-3 (J3'-4' 7.9 Hz) prezinta o diminuare a intensitatii, dupa cum se observa in Tabelul 1.
3. Competitia intre 2-piridil si diazinil ca grupe orto-directoare: regioselectivitatea globala
Deoarece incorporarea deuteriului a fost mai semnificativa in inelul diazinic, s-a tras concluzia ca gruparea 2-piridil este o GOD mai buna decat diazinele, in accord cu procentele prezentate in Tabelul 1: regioselectivitatea globala ~ 7:1 in 12-d, ~4:7 in 13-d si ~4:1 in 11-d. Aceste rezultate pot fi explicate prin mai buna stabilizare a intermediarilor litaiati corespunzatori complexarii litiului de catre azotul piridinic, mult mai bazic decat cei diazinici (Schema 15).

Schema 15
Aceste rezulate au fost utlizate, in continuare, pentru functionalizarea 2-piridildiazinelor 11-13 cu trei electrofili tipici: Ph2S2, ClSn(n-Bu)3 si p-MeO-C6H4-CHO (Schema 16).

Schema 16
Rezulatele obtinute au pus in evidenta, inca o data, aptitudinea de buna GOD a gruparii 2-piridil, regioselectivitatile fiind mai bune decat in cazul deuteriului.
BIBLIOGRAFIE
1. Tilford, C. H.; Van Campen Jr., M. G.; Shelton, R. S. J. Am. Chem. Soc. 1947, 69, 2902-2906
2. Pedrazzoli, A.; Tricerri, S. Helv. Chim. Acta 1956, 39, 965-976
3. Edgerton, W. H.; Fisher, J. R.; Moersch, G. W. J. Am. Chem. Soc. 1957, 79, 6487-6490
4. a) Barbulescu, N.; Moga, S.; Sintamarian, A. Rom. Pat. 81,796; Chem. Abstr. 1984, 101, P130434j; b) Barbulescu, N.; Moga, S.; Sintamarian, A.; Petcu, M.; Serban, F. Rom. Pat. 81,795; Chem. Abstr. , 102, P95631t; c) Barbulescu, N.; Moga, S.; Sintamarian, A. Rom. Pat. 82,826; Chem. Abstr. 1985, 102, P95630s; d) Barbulescu, N.; Moga, S.; Sintamarian, A.; Cuza, O.; Vasilescu, V. Rom. Pat. 83,939; Chem. Abstr. , 102, P149252r
Nouguier, R.; Crozet, M.; Vanelle, P.; Maldonado, J. Tetrahedron Lett. 1985, 26, 45, 5523-5524
6. Zayed, S. E., Pak. J. Sci. Ind. Res. 1987, 30, 6, 432-438; cf. Chem. Abstr y
7. Vanelle, P.; De Meo, M.P.; Maldonado, J.; Nouguier, R.; Crozet, M. P.; Lager, M. and Dumenil, G. Eur. J. Med. Chem. 1990, 25, 241-250
8. Mattson, A. and Norin, T. Synth. Comm. 1994, 24, 1489-91
9. Senkus, M. J. Am. Chem. Soc.
Laurent, A. P; Riehl, M. and Frazao, S. C. Bull. Soc. Chim. Fr. 1967, 10, 3868-72
Katritzky, A. R.; Pozharskii, A. F. Handbook of Heterocyclic Chemistry, Second Edition, Pergamon 2000
12. F. Mongin, G. Queguiner Tetrahedron 2001, 57, 4059-4090
13. A. Turck, N. Plé, F. Mongin, G. Queguiner Tetrahedron 2001, 57, 4489-4505
14. J. A. Zoltewicz, C. D. Dill Tetrahedron 1996, 52, 14469-14474
15. J. K. Still Angew. Chem. Int. Ed. Engl. 1986, 25, 508-524
LISTA DE LUCRARI
First Example of Selective Nucleophilicity of 1-Aza-5-hydroxymethyl-3,7-dioxabicyclo[3.3.0]octanes in Alkoxide Form
C. Berghian, C. Maiereanu, N. Plé, G. Plé, M. Darabantu
Studia Univ. Babes-Bolyai, Serie Chemia, XLVIII, 2003, 2, 113-125
2. First Example of 1-Aza-3,7-dioxabicyclo[3.3.0]octane-5-yl-methoxy System as Directed Ortho- Metallation Group
C. Berghian, C. Maiereanu, N. Plé, A. Turck, E. Condamine, M. Darabantu
3. 1-Aza-3,7-dioxabicyclo[3.3.0]octanes Substituted at C-5 position -From Local to Global Stereochemistry
M. Darabantu, C. Maiereanu, I. Silaghi-Dumitrescu, L. Toupet, E. Condamine, Y. Ramondenc, C. Berghian, G. Plé, N. Plé
Eur. J. Org.Chem., 2004, 12, 2644-266
4. Adjacent Ring Directed Ortho Metallation by the 2-Pyridyl Group in 2-Pyridyldiazines
C. Berghian, M. Darabantu, N. Ple, A. Turck
Rev. Rom. Chim. 50 (1), 2005 in press
5. First Preliminary Report on 3,7-Dioxa-r-1-azabicyclo[3.3.0]oct-c-5-ylmethoxy System Substituting s-Triazine
C. Berghian, N. Plé, A. Turck, M. Darabantu
Studia Babes Bolyai Serie Chemia, 2005 in press
First Examples of the Conformation Chirality of Heterobicyclo[3.3.0]octanes: 3,7-Dioxa-r-1-azabicyclo[3.3.0]oct-c-5-yl-methoxypyrazines
C. Berghian, M. Darabantu, P. Lameiras, N. Plé, A. Turck
Hetereocyclic Comm., 2005 in press
7. Metalation of Pyridin-2-yldiazines. Use of Pyridine Ring as Ortho-Directing Group. Diazines Part 45
C. Berghian, M. Darabantu, A. Turck, N. Plé
Tetrahedron, 2005 submited
PARTICIPARI LA SIMPOZIOANE
New 1-Aza-3,7-dioxabicyclo[3.3.0]octanes Functionalized at C-5 Position. Functionalization as (pi)deficient Systems
C. Berghian, C. Maiereanu, I. Silaghi-Dumitrescu, N. Ple, A. Turck, G. Ple
3rd International Conference of the Chemical Societies of the Southern-Eastern European Countries on Chemistry in the New Millennium-an Endless Frontier, Bucharest, Romania 22-25 Septembre 2002
Metallation et Fonctionnalisation de 2-Pyridyldiazines
C. Berghian, M. Darabantu, A. Turck, N. Ple
JCO (Journees de Chimie Organique), Palaiseau, 3-4 Septembrie 2004
|