Starea de agregare a sistemelor naturale de hidrocarburi
Sistemele de hidrocarburi aflate în zacaminte zacaminte sunt sisteme termodinamice. Având în vedere ca procesul de exploatare decurge relativ lent, starea de echilibru se pastreaza, în general, pe toata durata exploatarii.
Sistemele termodinamice pot fi omogene, când au aceeasi compozitie chimica si aceleasi proprietati fizice în toate punctele, sau neomogene, când sunt alcatuite din mai multe faze, cu compozitii si proprietati diferit 151h79b e.
Un sistem termodinamic este caracterizat printr-un numar de parametri macroscopici intensivi (care nu depind de masa sistemului): temperatura, presiunea, potentialul chimic, densitatea s.a. si intensivi (care depind de masa sistemului): volumul, entalpia, energia s.a.
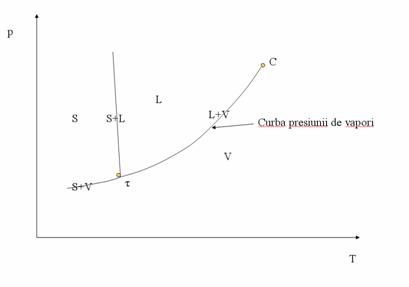
Prin faza se întelege o parte a unui sistem termodinamic neomogen, delimitata printr-o suprafata de separatie, si care se caracterizeaza (în absenta unui câmp extern de forte) prin aceleasi proprietati fizice în toate punctele sale. în legatura cu faza gazoasa se face urmatoarea mentiune: denumirile "vapori" si "gaze" sunt sinonime
 Sisteme monocomponente
Sisteme monocomponente
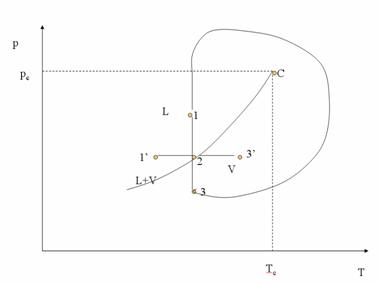
Trecerea sistemului din faza lichida (punctul L) în faza gazoasa (punctul G) se poate face în doua moduri: a) printr-o transformare directa a starii de agregare crescând temperatura, cu fierbere în punctul F; b) printr-o transformare care trece prin domeniul supercritic, traseul L - J - I - H - L, fara fierbere.
Curba τ - C mai poarta denumirea de curba presiunii de vapori.
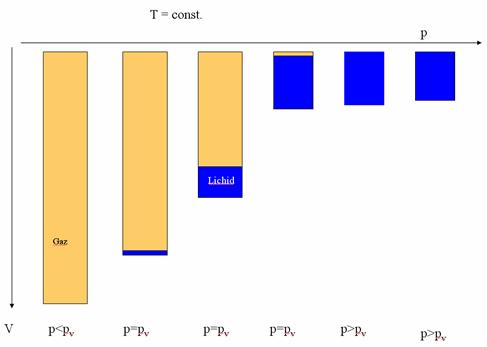
Se observa ca, în cursul fierberii, presiunea ramâne constanta la valoarea presiunea de vapori. Dupa terminarea vaporizarii (fierberii), presiunea scade pe masura ce volumul creste. De mentionat ca în sistemele mai complexe (cu mai multi componenti), transformarea este diferita de cea descrisa aici.
La încalzirea izobara (traseul L - F - G) a unui lichid, se constata ca în tot cursul vaporizarii temperatura ramâne constanta.
Începutul vaporizarii coincide cu sfârsitul condensarii, iar începutul condensarii cu sfârsitul vaporizarii. Cele doua denumiri indica sensul de variatie al parametrilor de stare
|
Componentul |
Temperatura normala de fierbere °C |
Parametii critici |
Factorul acentric |
||
|
Temperatura °C |
Presiunea 105 Pa |
Densitatea kg/m3 |
|||
|
Metan Etan Propan i-butan n-butan i-pentan n-pentan n-hexan Ciclohexan Benzen Toluen n-heptan n-octan n-xilen |
-161,58 -88,63 -42,07 -11,7 -0,5 27,83 36,07 68,74 81,0 80,1 110,63 98,43 125,67 139,1 |
-82,1 32,3 96,8 134,9 152,0 187,7 196,6 234,7 281,0 289,5 320,8 267,1 296,2. 346,0 |
46,41 48,84 42,57 36,48 37,93 33,34 33,77 30,34 41,14 49,24 42,15 27,28 24,93 35,46 |
162 203 220 221 221 232 232 234 272 300 290 237 233 270 |
0,0074 0,0981 0,1532 0,1825 0,2008 0,2400 0,2522 0,3007 0,2128 0,2137 0,2651 0,3507 0,3998 0,3216 " |
Sisteme binare
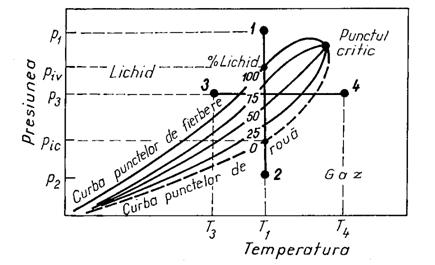 La sistemele cu doi componenti, cele
doua faze, lichida si gazoasa coexista într-o
infinitate de puncte (p, T), care alcatuiesc un domeniu
plan. Acest domeniu este delimitat de cel în care sistemul se afla în
lichida de curba punctelor de fierbere (de început al
vaporizarii) si de domeniul în care sistemul se afla în
stare gazoasa de curta punctelor de roua (de început al
condensarii).
La sistemele cu doi componenti, cele
doua faze, lichida si gazoasa coexista într-o
infinitate de puncte (p, T), care alcatuiesc un domeniu
plan. Acest domeniu este delimitat de cel în care sistemul se afla în
lichida de curba punctelor de fierbere (de început al
vaporizarii) si de domeniul în care sistemul se afla în
stare gazoasa de curta punctelor de roua (de început al
condensarii).
În zacamintele de hidrocarburi nu se întâlnesc sisteme cu doi componenti si nici sisteme cu un singur component Totusi, studiul comportarii unor astfel de sisteme face mai usoara întelegerea sistemelor naturale complexe.
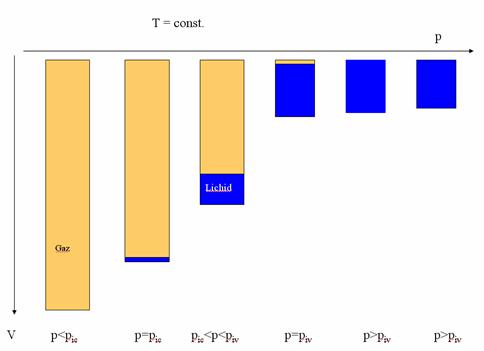
Initial, la presiunea p1 sistemul se afla în stare lichida. El ramâne în aceasta stare pâna la presiunea de început al vaporizarii piv. Între presiunile piv si pic (presiunea de început al condensarii), sistemul se îmbogateste treptat în faza gazoasa.
Transformarea starii de agregare se termina la presiunea pic, când întregul sistem a trecut în stare gazoasa. Continuând destinderea de la pic pâna la presiunea p2, sistemul ramâne în faza gazoasa. Presiunile piv si pic sunt specifice pentru o temperatura data.
Transformarea descrisa mai sus se numeste transformare normala, ea decurgând în acelasi sens ca si la sistemele monocomponente. Tot o transformare normala se va obtine si la o încalzire izobara 3 - 4.
Cele doua presiuni piv si pic sunt presiuni de saturatie: presiuni la care, la o temperatura data, într-un sistem monofazic începe sa se formeze a doua faza. Ele sunt specifice unei temperaturi date.
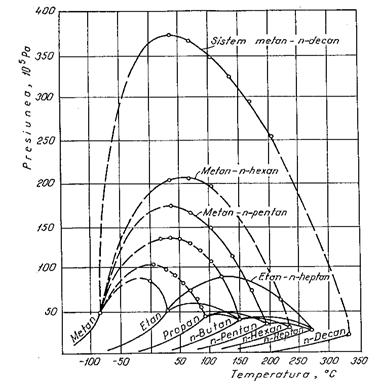 Pentru
punctul critic, la definitia anterioara (proprietatile
intensive ale lichidului si gazului se identifica), se mai poate da
si o alta definitie: el reprezinta punctul de
convergenta a curbei punctelor de fierbere cu cea a punctelor de
roua. Parametrii critici ai sistemului binar depind de natura si
concentratia componentilor din sistem.
Pentru
punctul critic, la definitia anterioara (proprietatile
intensive ale lichidului si gazului se identifica), se mai poate da
si o alta definitie: el reprezinta punctul de
convergenta a curbei punctelor de fierbere cu cea a punctelor de
roua. Parametrii critici ai sistemului binar depind de natura si
concentratia componentilor din sistem.
|
Amestecul |
Presiun critica, Pa |
Raport Pcmax/pc |
|
Metan etan Metan propan Metan n-butan Metan n-entan Metan n-hexan Metan- n-decan | ||
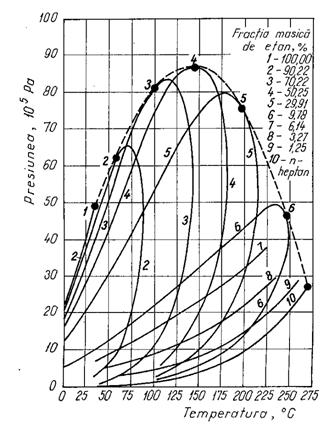
Sisteme ternare
Comportarea sistemelor ternare este asemanatoare cu cea a sistemelor binare. Diagrama de stare este similara cu cea a sistemelor cu doi componeti. Deosebirea este ca domeniul bifazic este mai extins. Punctul critic al unui sistem ternar se gaseste în interiorul triunghiului curbiliniu mar-ginit de curbele care unesc punctele critice ale celor trei sisteme binare ce se pot alcatui din cei trei componenti. Pentru un sistem alcatuit din C1-CO2-C10, diagrama de stare (p,T) este prezentata în figura.
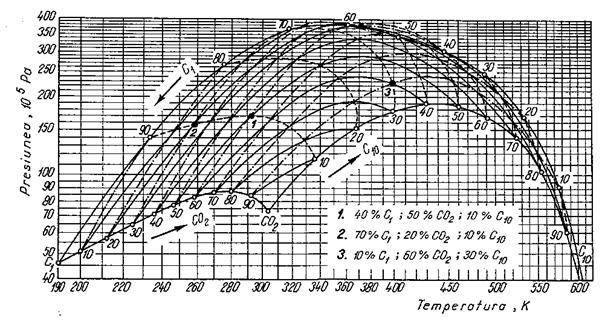 Presiunea critica a unui sistem
ternar scade pe masura ce creste fractia componentului
intermediar si, invers, creste pe masura ce sistemul devine
mai sarac în componentul intermediar. Acest fapt are o important
practica deosebita. În conditii de zacamânt este
necesara, uneori, obtinerea unui sistem monofazic prin injectia
de fluide. Pentru ca presiunea necesara sa nu fie excesiv de mare,
trebuie ca sistemul sa aiba o presiune critica mica.
Aceasta se poate realiza prin injectia unui sistem bogat în
componenti intermediari.
Presiunea critica a unui sistem
ternar scade pe masura ce creste fractia componentului
intermediar si, invers, creste pe masura ce sistemul devine
mai sarac în componentul intermediar. Acest fapt are o important
practica deosebita. În conditii de zacamânt este
necesara, uneori, obtinerea unui sistem monofazic prin injectia
de fluide. Pentru ca presiunea necesara sa nu fie excesiv de mare,
trebuie ca sistemul sa aiba o presiune critica mica.
Aceasta se poate realiza prin injectia unui sistem bogat în
componenti intermediari.
|